名校
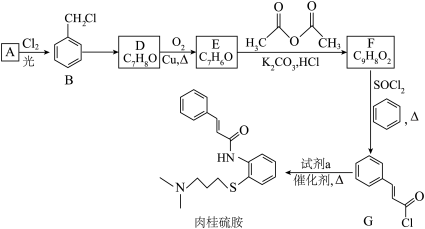
1 . 药物“肉桂硫胺”的部分合成路线如图所示(部分反应条件已略去):___________ ,A→B的化学方程式是___________ 。
(2)有机物D中所含的官能团的名称是___________ 。
(3)B→D的化学反应类型是___________ 。
(4)下列关于A的说法正确的是___________ (填字母)。
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是___________ 。
(6)有机物F为反式结构,其结构简式是___________ 。
已知:
(2)有机物D中所含的官能团的名称是
(3)B→D的化学反应类型是
(4)下列关于A的说法正确的是
a.能使酸性高锰酸钾溶液褪色
b.分子中所有原子位于同一平面
c.一氯代物有4种
(5)D→E的化学方程式是
(6)有机物F为反式结构,其结构简式是
您最近一年使用:0次
名校
解题方法
2 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2O )可看作是SO
)可看作是SO 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子 排布式是___________ 。
(2)S2O 的空间结构是
的空间结构是___________ 。
(3)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。晶胞中的[Mg(H2O)6]2+个数为___________ 。已知MgS2O3·6H2O的摩尔质量是Mg/mol,阿伏加德罗常数为NA,该晶体的密度为___________ g/cm3。(1 nm =10-7cm) 作为配体可提供孤电子对与Au+形成
作为配体可提供孤电子对与Au+形成 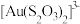 。分别判断S2O
。分别判断S2O 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:___________ 。
 )可看作是SO
)可看作是SO 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。(1)基态S原子
(2)S2O
 的空间结构是
的空间结构是(3)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。晶胞中的[Mg(H2O)6]2+个数为

 作为配体可提供孤电子对与Au+形成
作为配体可提供孤电子对与Au+形成 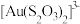 。分别判断S2O
。分别判断S2O 中的中心S原子和端基S原子能否做配位原子并说明理由:
中的中心S原子和端基S原子能否做配位原子并说明理由:
您最近一年使用:0次
名校
3 . 金属K和C60能够发生反应产生一系列金属球碳盐KxC60,部分金属球碳盐具有超导性,是球碳族化合物的研究热点之一。
(1)金属K中含有的化学键是___________ 键。
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于___________ 晶体,每个C60分子周围等距离且紧邻的C60有___________ 个。 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。___________ 。
② KxC60的熔点高于C60,原因是___________ 。
(1)金属K中含有的化学键是
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于

 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
② KxC60的熔点高于C60,原因是
您最近一年使用:0次
4 . 醇脱水是合成烯烃的常用方法,实验室合成环己烯的实验装置如下:
合成步骤:
在a中加入 环乙醇和2小片碎瓷片,冷却搅动下慢慢加入
环乙醇和2小片碎瓷片,冷却搅动下慢慢加入 浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过
浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过 。
。
分离提纯:
将反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯 。
。
回答下列问题:
(1)装置b的名称是___________ 。
(2)如果加热一段时间后发现忘加沸石,应该采取的正确操作是___________ 。
(3)若反应温度偏低,最容易产生的有机副产物的结构简式为___________ ,写出该反应的化学反应方程式___________ 。
(4)在本实验分离过程中,产物应该从分液漏斗的___________ (填“上口倒出”或“下口倒出”)。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________ (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(6)本实验中环己烯的产率是___________ 。

| 相对分子质量 | 密度/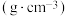 | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入
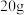 环乙醇和2小片碎瓷片,冷却搅动下慢慢加入
环乙醇和2小片碎瓷片,冷却搅动下慢慢加入 浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过
浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过 。
。分离提纯:
将反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯
 。
。回答下列问题:
(1)装置b的名称是
(2)如果加热一段时间后发现忘加沸石,应该采取的正确操作是
(3)若反应温度偏低,最容易产生的有机副产物的结构简式为
(4)在本实验分离过程中,产物应该从分液漏斗的
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(6)本实验中环己烯的产率是
您最近一年使用:0次
5 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第___________ 周期第___________ 族,Co位于元素周期表___________ 区。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是___________ 。
(4)已知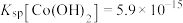 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为___________  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为___________ 。
(5)导致 比
比 易水解的因素有
易水解的因素有___________ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
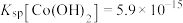 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
名校
解题方法
6 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
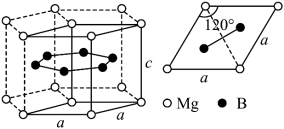
您最近一年使用:0次
名校
7 . 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中只有C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
请回答下列问题:
(1)C是_______ (填元素名称)。
(2)上述元素中位于s区的有_______ (填元素符号)。
(3)与 互为等电子体的阴离子为
互为等电子体的阴离子为_______ 。
(4)已知C的氧化物CO与NiO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO_____ NiO(填“>”“<”或“=”)。
(5)浸金时,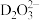 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成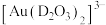 。
。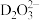 中的配位原子为
中的配位原子为_____ (填元素符号),其位置在______ (填“中心”或“端位”),理由是______ 。
 ;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。
;B和D也属同一族,它们原子最外层的p能级电子数是最外层的s能级电子数的两倍;C基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。请回答下列问题:
(1)C是
(2)上述元素中位于s区的有
(3)与
 互为等电子体的阴离子为
互为等电子体的阴离子为(4)已知C的氧化物CO与NiO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm,则熔点:CO
的离子半径分别为66pm和69pm,则熔点:CO(5)浸金时,
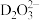 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成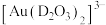 。
。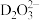 中的配位原子为
中的配位原子为
您最近一年使用:0次
名校
解题方法
8 . 有机化合物乙偶姻存在于啤酒中,是酒类调香中一种极其重要的化合物。某研究性学习小组为确定乙偶姻的结构,进行如下探究。
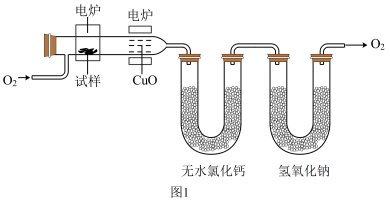
步骤一:将乙偶姻蒸气和氧气的混合气体通过热的氧化铜(催化剂)氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收,装置如图1。 乙偶姻的蒸气氧化产生
乙偶姻的蒸气氧化产生 二氧化碳和
二氧化碳和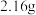 水。
水。
步骤二:升温使乙偶姻汽化,测其密度是相同条件下 的44倍。
的44倍。
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4组峰的面积比为 。
。___________ 。
(2)乙偶姻的摩尔质量为___________ 。
(3)乙偶姻的分子式为___________ 。
(4)乙偶姻的结构简式为___________ 。
(5)通过仪器分析也可知相对分子质量,该方法为___________ 。某烃A的相对分子质量为84,不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则此烃A的结构简式为___________ 。
(6)四氢糠醇( )可用作明胶溶液的稳定剂、印染工业的润湿剂和分散剂以及某些药品的脱色、脱臭剂等。请写出四氢糠醇的含有羧基的所有同分异构体:
)可用作明胶溶液的稳定剂、印染工业的润湿剂和分散剂以及某些药品的脱色、脱臭剂等。请写出四氢糠醇的含有羧基的所有同分异构体:___________ 。
步骤一:将乙偶姻蒸气和氧气的混合气体通过热的氧化铜(催化剂)氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收,装置如图1。
 乙偶姻的蒸气氧化产生
乙偶姻的蒸气氧化产生 二氧化碳和
二氧化碳和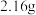 水。
水。步骤二:升温使乙偶姻汽化,测其密度是相同条件下
 的44倍。
的44倍。步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4组峰的面积比为
 。
。

(2)乙偶姻的摩尔质量为
(3)乙偶姻的分子式为
(4)乙偶姻的结构简式为
(5)通过仪器分析也可知相对分子质量,该方法为
(6)四氢糠醇(
 )可用作明胶溶液的稳定剂、印染工业的润湿剂和分散剂以及某些药品的脱色、脱臭剂等。请写出四氢糠醇的含有羧基的所有同分异构体:
)可用作明胶溶液的稳定剂、印染工业的润湿剂和分散剂以及某些药品的脱色、脱臭剂等。请写出四氢糠醇的含有羧基的所有同分异构体:
您最近一年使用:0次
名校
9 . 有机物M是一种制备液晶材料的重要中间体,其合成路线如图: (格林试剂)
(格林试剂)  、Br、I
、Br、I_______ 。
(2)在本流程中与三甲基氯硅烷( )起类似作用的有机物还有
)起类似作用的有机物还有_______ (填名称)。
(3)H的分子式是_______ ,F与H在浓盐酸作用下发生的反应类型为_______ 。
(4)L中的官能团有_______ (填名称),M的结构简式为_______ 。
(5)写出一种符合下列条件的E的同分异构体_______ (不考虑立体异构)。
①能与金属钠反应产生氢气 ②能发生银镜反应 ③含有1个手性碳原子
④核磁共振氢谱中显示六组峰且峰面积比为6∶2∶1∶1∶1∶1
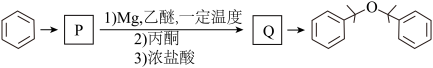
(6)以苯和丙酮为原料合成 的路线如下图,根据题中信息写出化合物P和Q的结构简式
的路线如下图,根据题中信息写出化合物P和Q的结构简式
P:_______ 、Q:_______ 。

 (格林试剂)
(格林试剂)  、Br、I
、Br、IⅡ.
Ⅲ.
(2)在本流程中与三甲基氯硅烷(
 )起类似作用的有机物还有
)起类似作用的有机物还有(3)H的分子式是
(4)L中的官能团有
(5)写出一种符合下列条件的E的同分异构体
①能与金属钠反应产生氢气 ②能发生银镜反应 ③含有1个手性碳原子
④核磁共振氢谱中显示六组峰且峰面积比为6∶2∶1∶1∶1∶1
(6)以苯和丙酮为原料合成
 的路线如下图,根据题中信息写出化合物P和Q的结构简式
的路线如下图,根据题中信息写出化合物P和Q的结构简式P:
您最近一年使用:0次
名校
解题方法
10 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)卤素位于周期表中的_______ 区。其中溴原子的价电子排布图为_______ 。
(2)-40℃时,F2与冰反应生成HF与极不稳定的HOF。常温常压下,HOF为无色气体,固态HOF的晶体类型为_______ 。为获知HOF分子的键长、键角数据,可以借助的现代仪器分析手段是_______ 。
(3)HOF又名氟氧酸,温度高于0℃时极易分解为O2与HF。从化合价的角度分析,该反应可归类为非氧化还原反应,试分析其原因_______ 。
(4)一氯乙烯(C2H3Cl)分子中,C的一个_______ 杂化轨道与Cl的3px轨道形成C-Cl_______ 键,并且Cl的3pz轨道与C的2px轨道形成3中心4电子的大π键 。
。
(5)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是_______ ,理由:(ⅰ)C的杂化轨道中s成分越多,形成的C-Cl键越强;(ⅱ)_______ 。
(6)Pt(NH3)2Cl2是一种常见的抗癌药。已知基态Pt原子的价电子排布式为5d96s1。经检测该物质具有反磁性(分子中不含成单电子),试分析其中的Pt是否为sp3杂化(分子构型未知):结论:_______ 。分析:_______ 。
(1)卤素位于周期表中的
(2)-40℃时,F2与冰反应生成HF与极不稳定的HOF。常温常压下,HOF为无色气体,固态HOF的晶体类型为
(3)HOF又名氟氧酸,温度高于0℃时极易分解为O2与HF。从化合价的角度分析,该反应可归类为非氧化还原反应,试分析其原因
(4)一氯乙烯(C2H3Cl)分子中,C的一个
 。
。(5)一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C-Cl键长的顺序是
(6)Pt(NH3)2Cl2是一种常见的抗癌药。已知基态Pt原子的价电子排布式为5d96s1。经检测该物质具有反磁性(分子中不含成单电子),试分析其中的Pt是否为sp3杂化(分子构型未知):结论:
您最近一年使用:0次



