名校
1 . 化合物X(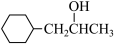 )是一种重要的化工原料,可以由乙炔钠和化合物A等为原料合成。流程图如下:
)是一种重要的化工原料,可以由乙炔钠和化合物A等为原料合成。流程图如下:

已知:(a)
(1)化合物X中的官能团名称是
(2)CH2=CH-CH=CH2的名称为
(3)化合物A是一种链烃,相对分子质量为42,A的结构简式是
(4)B的分子式是C3H5Cl,所含官能团为
(5)C的结构简式是
(6)写出反应④的化学方程式
(7)写出反应⑥的化学方程式
您最近一年使用:0次
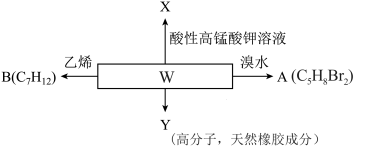
2 . 化合物W为2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如
(1)化合物A存在顺反异构,写出A的结构简式______________ 。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________ 。
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是___________ (填字母) 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸(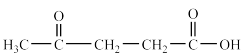 )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为_____________ 。
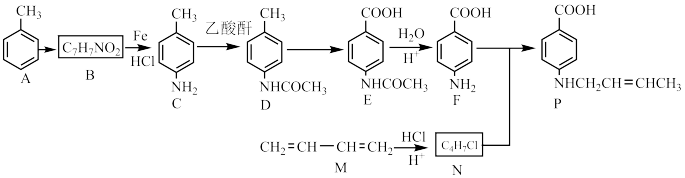
Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
①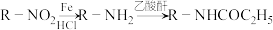
② 具有较强的还原性
具有较强的还原性
回答下列问题:
(5)B的结构简式为______________ ,F中含氧官能团的名称为______________ 。
(6)D→E转化需加入的试剂为___________ 。设计C→D步骤的目的是________________ 。
(7)M→N反应的化学方程式为______________ 。
(8)通过N、F合成P的反应属类型为_____________ ,合成过程中还需加入适量 可提高产率原因为
可提高产率原因为______________ 。
已知:
I.共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃)可以与含碳碳双键的化合物在一定条件下发生第尔斯-阿尔德(Diels-Alder)反应,得到环状产物。
例如: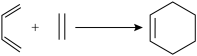
 溶液反应时,不同的结构可以得到不同的氧化产物。如
溶液反应时,不同的结构可以得到不同的氧化产物。如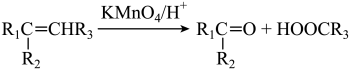 。
。
(1)化合物A存在顺反异构,写出A的结构简式
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式
(3)第尔斯-阿尔德(Diels-Alder)反应在有机合成中有重要作用,下列不能与乙烯发生Diels-Alder反应的有机物是
a. b.
b.  c.
c. d.
d.
 溶液氧化,得到乙酸(
溶液氧化,得到乙酸( )琥珀酸(
)琥珀酸( )丙酮
)丙酮 三者的混合物,则H的结构简式为
三者的混合物,则H的结构简式为Ⅱ以甲苯为原料可制得重要的药物合成中间体P,合成线路如下所示:
①
②
 具有较强的还原性
具有较强的还原性回答下列问题:
(5)B的结构简式为
(6)D→E转化需加入的试剂为
(7)M→N反应的化学方程式为
(8)通过N、F合成P的反应属类型为
 可提高产率原因为
可提高产率原因为
您最近一年使用:0次
3 . 2-溴戊二酸二甲酯(相对分子质量为239)是某抗癌药物的重要中间体,其制备的反应原理如图所示:
步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
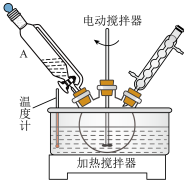
(1)使用装置A的优点是_____________ ,三颈烧瓶宜选择的规格是__________ (填标号)。
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有_____________ 。
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是_______________ 。
(4)步骤三中使用减压蒸馏的目的是______________ 。
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是_______________ ,反应中生成中间产物1(戊二酰氯)的同时得到两种有刺激性气味的气体,该反应的化学方程式为________________ 。
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是_____________ 。
(7)本实验的产率约是 。

步骤一:制备
将10.0g戊二酸(固态,相对分子质量为132)加入到三颈烧瓶中,再向其中加入三氯甲烷25mL,搅拌均匀,保持78℃条件下,依次缓慢滴加12mL氯化亚砜、3滴催化剂、10ml液溴,随后回流;回流完毕后,将三颈烧瓶置于冰盐浴中,将溶液温度降到-10℃后,缓慢滴加25mL甲醇(沸点64.7℃)保持滴加过程中温度不超过0℃。
步骤二:除杂
向三颈烧瓶中加入25mL饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用25mL饱和氯化钠溶液洗涤3次,洗涤完毕,“用无水硫酸镁干燥,过滤。
步骤三:提纯
过滤后的液体置于热浴容器中(外温170℃),接上精馏装置,进行减压蒸馏。
步骤四:收集
收集100—110℃的馏分,得到10.86g无色透明油状液体。
回答下列问题:
(1)使用装置A的优点是
A.50mL B.150mL C.200mL D.500mL
(2)步骤一中采取“温度降到-10℃”“缓慢滴加”这些措施的可能原因有
a.减缓反应速率
b.防止高温下发生复杂的有机副反应
c.避免原料挥发,使反应物充分反应
(3)步骤二中用饱和氯化钠溶液洗涤的目的是
(4)步骤三中使用减压蒸馏的目的是
(5)中间产物Ⅰ比戊二酸的沸点低很多的原因是
(6)从环保角度分析,该实验装置存在明显不足之处,解决的办法是
(7)本实验的产率约是 。
| A.30% | B.50% | C.60% | D.80% |
您最近一年使用:0次
名校
4 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第VⅢ族的元素,在化学上称为铁系元素,其合金和化合物在生产生活中应用广泛。
(1)基态Ni原子的价层电子排布图为_____________ 。
(2) 的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是
的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是_____________ ,氮有_____________ 种不同空间运动状态的电子。
(3) 在水溶液中以
在水溶液中以 的形式存在。向含
的形式存在。向含 的溶液中加入过量氨水可生成更稳定的
的溶液中加入过量氨水可生成更稳定的 ,试分析
,试分析 更稳定的原因是
更稳定的原因是________________ 。
(4)硫酸镍溶于氨水形成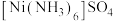 蓝色溶液。
蓝色溶液。
① 的空间构型为
的空间构型为_____________ 。
②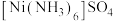 含有的化学键类型包括
含有的化学键类型包括_____________ (填字母)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度
__________  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列出计算式即可)。
,列出计算式即可)。
(1)基态Ni原子的价层电子排布图为
(2)
 的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是
的检验试剂常用硫氰化钾(KSCN),K、S、C、N四种元素中电负性最大的是(3)
 在水溶液中以
在水溶液中以 的形式存在。向含
的形式存在。向含 的溶液中加入过量氨水可生成更稳定的
的溶液中加入过量氨水可生成更稳定的 ,试分析
,试分析 更稳定的原因是
更稳定的原因是(4)硫酸镍溶于氨水形成
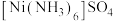 蓝色溶液。
蓝色溶液。①
 的空间构型为
的空间构型为②
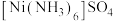 含有的化学键类型包括
含有的化学键类型包括A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键
(5)一种Al-Fe合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。若此合金中Al、Fe原子核中心之间最近的距离为a pm,则此合金的密度

 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列出计算式即可)。
,列出计算式即可)。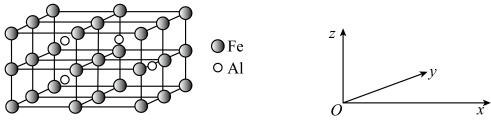
您最近一年使用:0次
解题方法
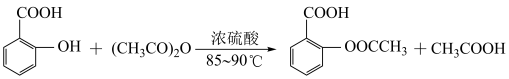
5 . 阿司匹林的有效成分是乙酰水杨酸( 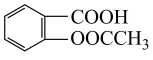 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
回答下列问题:
(1)合成过程中最合适的加热方法是
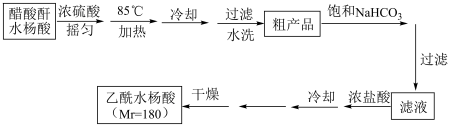
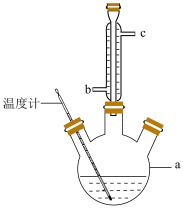
(2)提纯粗产品流程如下,加热回流装置如图:
①沸石的作用是
②冷凝水的流出方向是
③使用温度计的目的是
(3)检验最终产品中是否含有水杨酸的化学方法是
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;
Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
①研碎时用到的实验仪器有
②写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
③阿司匹林药片中乙酰水杨酸质量分数的表达式为
您最近一年使用:0次
名校
解题方法
6 . 按要求回答下列问题。
(1) 的熔点为
的熔点为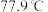 ,
, 的熔点为
的熔点为 ,二者熔点差异的原因是
,二者熔点差异的原因是___________ 。
(2) 形成的多种化合物中常见的有
形成的多种化合物中常见的有 和金红石
和金红石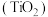 ,两种晶体熔融状态下都能够导电,则它们属于
,两种晶体熔融状态下都能够导电,则它们属于___________ (填晶体类型),两种晶体比较, 熔点较高,其原因是
熔点较高,其原因是___________ 。
(3)工业上均采用碳酸盐分解法制取氧化镁与生石灰, 的分解温度
的分解温度___________ (填“高于”或“低于”) 。
。
(4)已知单质铁有如图所示的三种堆积方式的晶胞结构:___________ 堆积;
②用含有 的式子表示出晶胞b的空间利用率
的式子表示出晶胞b的空间利用率___________ ;
③若晶胞c的密度为 ,则铁的原子半径r=
,则铁的原子半径r=___________ cm。(用含 、
、 的式子表示,
的式子表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)
 的熔点为
的熔点为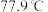 ,
, 的熔点为
的熔点为 ,二者熔点差异的原因是
,二者熔点差异的原因是(2)
 形成的多种化合物中常见的有
形成的多种化合物中常见的有 和金红石
和金红石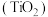 ,两种晶体熔融状态下都能够导电,则它们属于
,两种晶体熔融状态下都能够导电,则它们属于 熔点较高,其原因是
熔点较高,其原因是(3)工业上均采用碳酸盐分解法制取氧化镁与生石灰,
 的分解温度
的分解温度 。
。(4)已知单质铁有如图所示的三种堆积方式的晶胞结构:
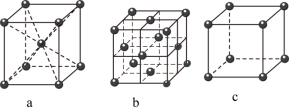
②用含有
 的式子表示出晶胞b的空间利用率
的式子表示出晶胞b的空间利用率③若晶胞c的密度为
 ,则铁的原子半径r=
,则铁的原子半径r= 、
、 的式子表示,
的式子表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
7 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。___________ 。
(2)C、N、O三种元素电负性从大到小的顺序为___________ ;第一电离能I1(P)___________ I1(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为___________ 。
(4)如图所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ (用化学式表示)。___________ 个碳原子,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=___________ a。

(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)如图所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

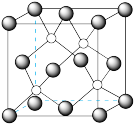
您最近一年使用:0次
名校
8 . 2020年9月22日,中国政府在第75届联合国大会上提出:“中国将提高国家自主贡献力度,采取更有力的政策和措施。二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。” 碳中和也叫碳补偿(Carbon Offset),是现代人为减缓全球变暖所作的努力之一。碳中和的实现方式包括两种:一是通过植树造林等方式增加CO2的吸收量,二是通过技术手段减少CO2的排放量。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌ CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g) ⇌ CH3OH(g) △H2= —99kJ·mol-1
(1)总反应的
_______ kJ·mol-1;
(2)氢氧燃料电池具有启动快,效率高等优点,若电解质为酸性,氢氧燃料电池的正极反应为_______
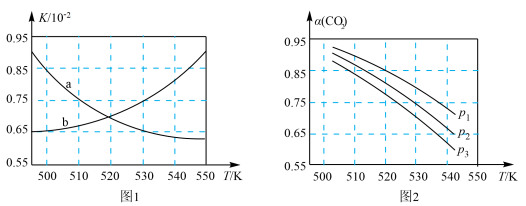
(3)图1中能正确反映平衡常数K随温度变化关系的曲线为_______ (填曲线标记字母),体系中的CO2平衡转化率(a)与温度和压强的关系如图2所示,则图2中的压强由大到小为_______ 。_______ (用含a的式子表示)。
Ⅱ. 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: 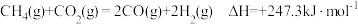 。回答下列问题:
。回答下列问题:
(5)该反应体系的熵值变化为_______ (填“增加”或“减小”);根据公式△G=△H—T△S判断:此反应在_______ (填“低温”或“高温”)条件下可以自发进行。
(6)其它条件相同,在不同催化剂(A、B)作用下,反应 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图3所示。
的产率随反应温度的变化如图3所示。_______ ,在催化剂A、B作用下,它们反应活化能分别用 、
、 表示,则
表示,则
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(7)将原料 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图4所示,则在
体积分数与温度的关系如图4所示,则在 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=_______ 。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)⇌ CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g) ⇌ CH3OH(g) △H2= —99kJ·mol-1
(1)总反应的

(2)氢氧燃料电池具有启动快,效率高等优点,若电解质为酸性,氢氧燃料电池的正极反应为
(3)图1中能正确反映平衡常数K随温度变化关系的曲线为
Ⅱ.
 和
和 的催化重整对温室气体的减排具有重要意义,其反应为:
的催化重整对温室气体的减排具有重要意义,其反应为: 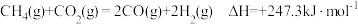 。回答下列问题:
。回答下列问题:(5)该反应体系的熵值变化为
(6)其它条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图3所示。
的产率随反应温度的变化如图3所示。 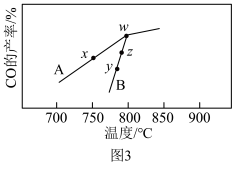
 、
、 表示,则
表示,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(7)将原料
 和
和 按等物质的量充入密闭容器中,保持体系压强为
按等物质的量充入密闭容器中,保持体系压强为 发生反应:
发生反应: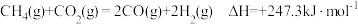 。达到平衡时,
。达到平衡时, 体积分数与温度的关系如图4所示,则在
体积分数与温度的关系如图4所示,则在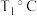 、
、 下,达平衡时
下,达平衡时 转化率=
转化率=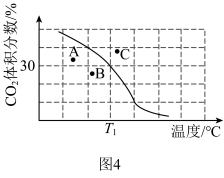
您最近一年使用:0次
名校
解题方法
9 . 实验室由安息香(M=212g/mol)制备二苯乙二酮(M=210g/mol)的反应式如下:
装置示意图如下图所示,实验步骤为:
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min
③加入50mL水,煮沸后冷却,有黄色固体析出
④过滤,并用冷水洗涤固体3次,得到粗品
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g
回答下列问题:
(1)仪器B的作用是_______ ;冷却水应_______ (填“a”或“b”)口流出。
(2)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______ 。
(3)在本实验中,FeCl3为氧化剂且过量,其还原产物为_______ ;某同学尝试改进本实验:
采用催化量的FeCl3并通入空气制备二苯乙二酮,该方法的优点是_______ 。
(4)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是_______ 。
(5)若粗品中混有少量未氧化的安息香,可用少量_______ 洗涤的方法除去(填标号)。
a.冷水 b.热水 c.乙酸 d.乙醇
若要得到更高纯度的产品,可用_______ 的方法进一步提纯。
(6)本实验的产率最接近于_______ (填标号)。
a.85% b.80% c.75% d.70%

| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 安息香 | 白色固体 | 133 | 344 | 难溶于冷水、溶于热水、乙醇、乙酸 |
二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水、溶于乙醇、苯、乙酸 |
| 冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |

②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min
③加入50mL水,煮沸后冷却,有黄色固体析出
④过滤,并用冷水洗涤固体3次,得到粗品
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g
回答下列问题:
(1)仪器B的作用是
(2)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是
(3)在本实验中,FeCl3为氧化剂且过量,其还原产物为
采用催化量的FeCl3并通入空气制备二苯乙二酮,该方法的优点是
(4)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是
(5)若粗品中混有少量未氧化的安息香,可用少量
a.冷水 b.热水 c.乙酸 d.乙醇
若要得到更高纯度的产品,可用
(6)本实验的产率最接近于
a.85% b.80% c.75% d.70%
您最近一年使用:0次
名校
解题方法
10 . 请回答以下问题:
(1)基态碳原子的价电子排布不能表示为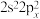 ,原因是违背
,原因是违背_______ 。
(2)下列有关乙烷(C2H6)和乙烯(C2H4)的描述正确的是_______(填字母)。
(3) 分子中Cl-C-Cl的键角
分子中Cl-C-Cl的键角_______ (填“>”、“<”或“=”)甲醛分子中H-C-H的键角。
(4)通常情况下,和乙烯的沸点(-103.7℃)比,氯乙烯(CH2=CHCl)的沸点更高(-13.9℃),其原因是_______ 。
(5)CO2在高温高压下所形成的晶体其晶胞如图所示。则该晶体的类型属于_______ 晶体;该晶体的熔点比SiO2晶体_______ (填“高”或“低”)_______ g/cm3(列出计算式即可)。
(1)基态碳原子的价电子排布不能表示为
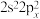 ,原因是违背
,原因是违背(2)下列有关乙烷(C2H6)和乙烯(C2H4)的描述正确的是_______(填字母)。
A.分子中均含有 键和 键和 键 键 | B.分子中的所有原子均处于同一平面上 |
| C.分子中的碳碳键键长:乙烯>乙烷 | D.乙烯中碳原子的杂化轨道类型为sp2 |
(3)
 分子中Cl-C-Cl的键角
分子中Cl-C-Cl的键角(4)通常情况下,和乙烯的沸点(-103.7℃)比,氯乙烯(CH2=CHCl)的沸点更高(-13.9℃),其原因是
(5)CO2在高温高压下所形成的晶体其晶胞如图所示。则该晶体的类型属于


您最近一年使用:0次



