名校
解题方法
1 . 将6.4 g铜加入50 mL 10 mol/L的硝酸溶液中,铜全部溶解,得到NO和NO2的混合气体(不考虑NO2与N2O4之间的相互转化)。将反应后溶液稀释至100 mL,测得 的浓度为3 mol/L。下列说法
的浓度为3 mol/L。下列说法错误 的是
 的浓度为3 mol/L。下列说法
的浓度为3 mol/L。下列说法| A.混合气体的物质的量为0.2 mol |
| B.稀释后溶液中H+的物质的量浓度为2 mol/L |
| C.反应中转移电子的物质的量为0.2 mol |
| D.硝酸在反应中部分体现氧化性,部分体现酸性 |
您最近半年使用:0次
名校
解题方法
2 . 以黄铁矿为原料来生产硫酸的工艺流程如图。下列说法错误 的是
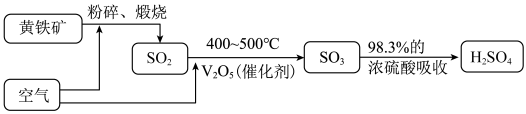
| A.一定条件下,2 mol SO2与足量O2充分反应转移4 mol 电子 |
| B.将黄铁矿粉碎的目的是增大接触面积,加快反应速率,提高原料的利用率 |
C.煅烧黄铁矿发生的反应为:4FeS2+11O2 2Fe2O3+8SO2,FeS2中S的化合价为-1价 2Fe2O3+8SO2,FeS2中S的化合价为-1价 |
| D.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾 |
您最近半年使用:0次
名校
3 . 铜及其化合物在生产生活有广泛应用,铜在化合物中的常见化合价有+1、+2.已知 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
(1)工业上可用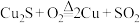 反应制取粗铜,该反应中
反应制取粗铜,该反应中___________ 元素被还原。不考虑杂质的反应,理论上生成1mol的 电子转移的数目为
电子转移的数目为___________
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为___________ 。温度控制在50~60℃的原因除了加快反应速率外,还有___________ 。在 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:___________ 。
(3)现向Cu、 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为___________ 。若将上述混合物用足量的 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为___________ g。若上述混合物中含0.2mol Cu,将该混合物与稀硫酸充分反应,消耗 的物质的量为
的物质的量为___________ mol。
 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。(1)工业上可用
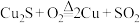 反应制取粗铜,该反应中
反应制取粗铜,该反应中 电子转移的数目为
电子转移的数目为(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入
 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:(3)现向Cu、
 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为 的物质的量为
的物质的量为
您最近半年使用:0次
名校
解题方法
4 . 用NA表示阿伏加德罗常数的值。下列叙述正确 的是
| A.64g Cu与S完全反应转移的电子数为NA |
| B.标准状况下, 11.2L SO3所含的分子数为0.5NA |
| C.足量的Cu与2 mol浓硫酸充分反应转移电子数目为2NA |
| D.1mol氯气与铁完全反应,转移的电子数为3NA |
您最近半年使用:0次
2024·江苏·模拟预测
5 . 利用碳氯化反应TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) ΔH =-51 kJ·mol-1,可将TiO2转化为TiCl4,再进一步还原得到金属钛,下列说法正确的是
TiCl4(g)+2CO(g) ΔH =-51 kJ·mol-1,可将TiO2转化为TiCl4,再进一步还原得到金属钛,下列说法正确的是
 TiCl4(g)+2CO(g) ΔH =-51 kJ·mol-1,可将TiO2转化为TiCl4,再进一步还原得到金属钛,下列说法正确的是
TiCl4(g)+2CO(g) ΔH =-51 kJ·mol-1,可将TiO2转化为TiCl4,再进一步还原得到金属钛,下列说法正确的是| A.碳氯化反应在高温下不能自发进行 |
| B.加压、降温均可增大生成TiCl4的速率 |
| C.反应中每消耗80g TiO2,转移电子的数目约为4×6.02×1023 |
| D.将TiO2(s)与C(s)粉碎并混合均匀后反应可提高Cl2的平衡转化率 |
您最近半年使用:0次
名校
6 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近半年使用:0次
名校
解题方法
7 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入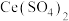 与
与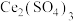 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=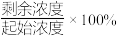 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。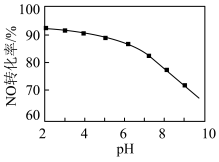
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入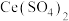 与
与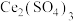 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。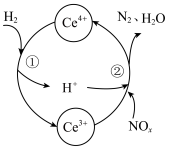
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=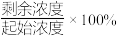 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是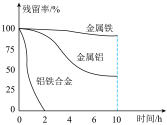
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
您最近半年使用:0次
2024-05-06更新
|
158次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
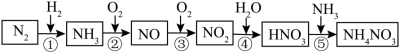
8 . 氮元素及其化合物的转化关系如图所示。___________ 。
(2)氮元素在元素周期表中的位置是___________ 。
(3)已知1molNH3发生反应②,完全反应生成NO和水蒸气时放出226 kJ的热,该反应的热化学方程式是___________ 。
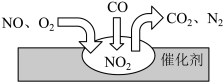
(4)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。___________ 。
②催化转化过程中,理论上每生成1mol 时,转移的电子为
时,转移的电子为___________ mol。
(2)氮元素在元素周期表中的位置是
(3)已知1molNH3发生反应②,完全反应生成NO和水蒸气时放出226 kJ的热,该反应的热化学方程式是
(4)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示。
②催化转化过程中,理论上每生成1mol
 时,转移的电子为
时,转移的电子为
您最近半年使用:0次
2024-05-06更新
|
56次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
9 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
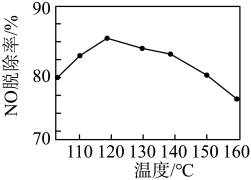
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近半年使用:0次
10 . 已知Ⅰ: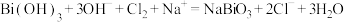 ;
;
Ⅱ.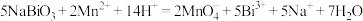 。下列推断不正确的是
。下列推断不正确的是
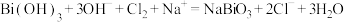 ;
;Ⅱ.
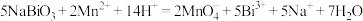 。下列推断不正确的是
。下列推断不正确的是A. 可与盐酸发生反应: 可与盐酸发生反应: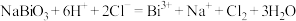 |
B.任何条件下,都存在氧化性: |
C.反应Ⅱ中,当有10.45g 生成时转移电子数为 生成时转移电子数为 |
D.已知 可由 可由 与王水(浓硝酸和浓盐酸的混合物)反应制取,说明 与王水(浓硝酸和浓盐酸的混合物)反应制取,说明 不能被硝酸氧化 不能被硝酸氧化 |
您最近半年使用:0次



