 、
、 、
、 、
、 、
、 和
和 七种。
七种。(1)请用上述物质填空(不用配平):
 。
。(2)上述反应中氧化剂是(填化学式)
(3)
 在上述反应中表现出来的性质是(填选项序号)______。
在上述反应中表现出来的性质是(填选项序号)______。| A.氧化性 | B.氧化性和酸性 | C.酸性 | D.还原性和酸性 |
B、
 与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:
与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为: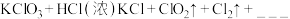
(4)请完成该化学方程式
(5)浓盐酸在反应中显示出来的性质是
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(6)若产生
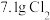 ,则生成
,则生成 的质量为
的质量为 。
。(7)
 具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是
具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是 的
的

(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
3 . 高铁酸钾( )是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在
)是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在 的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成
的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成 和
和 。
。
Ⅰ.湿法制备高铁酸钾。主要的生产流程如图所示:
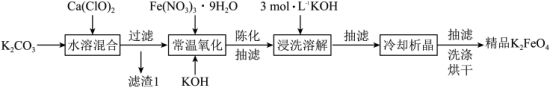
回答以下问题:
(1)滤渣1的主要成分为
(2)写出常温氧化过程的离子方程式
(3)氧化时需控温
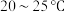 ,温度不能高于
,温度不能高于 原因是
原因是Ⅱ.某兴趣小组在实验室模拟湿法制备 ,装置如图所示:
,装置如图所示:
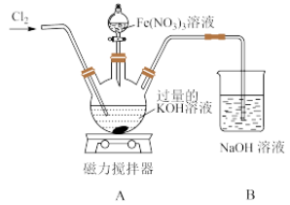
(4)通入的氯气不能过量的原因是
(5)制备的高铁酸钾粗产品中含有
 、
、 、
、 等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和
等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和 溶液、饱和
溶液、饱和 溶液、冷的稀
溶液、冷的稀 溶液、冰水)。
溶液、冰水)。①取一定量的高铁酸钾粗产品溶于
②过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液;
溶液;
③搅拌、静置、过滤,用 次,在真空干燥箱中干燥。
次,在真空干燥箱中干燥。
④实验结束时通入氮气的目的是
4 . 检验加“碘”盐含“ ”可通过在酸性条件下,加入碘化钾溶液和淀粉来实现。反应原理如下:
”可通过在酸性条件下,加入碘化钾溶液和淀粉来实现。反应原理如下: (未配平)。下列有关说法正确的是
(未配平)。下列有关说法正确的是
A. 是氧化剂 是氧化剂 |
B. 是氧化产物 是氧化产物 |
C.该反应中 只体现出了酸性 只体现出了酸性 |
D.每生成3个 分子,转移6个电子 分子,转移6个电子 |
A.制备 : : |
B. 和NaH反应: 和NaH反应: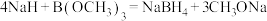 |
C.高温下Al2O3、焦炭在氯气中反应: |
D.用石墨作电极电解Al2O3的阴极电极方程式: |

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是
(2)生铁和钢相比,含碳量更高的是
(3)原料中焦炭的作用是
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:
 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式: 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为
(3)已知:
 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素
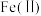 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是
(4)①将“钴镍渣”酸溶后,先加入
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成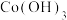 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
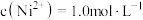 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中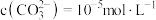 ,则沉镍率=
,则沉镍率=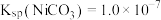 ,沉镍率
,沉镍率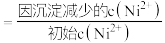 ]
]
8 . 铁、铝、铜等金属及其化合物在日常生活中应用广泛。
(1)生铁中含有一种铁碳化合物X,实验室测定该化合物X组成的实验如下,最终得到的固体2是
 。
。
①已知固体1有磁性,将其溶于过量盐酸后,溶液中含有的大量阳离子是 和
和
②溶液甲中通入足量的氯气,发生反应的离子方程式为
③X的化学式可表示为
(2)某溶液中有
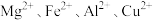 四种正离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并蒋灼烧的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______(填选项)。
四种正离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并蒋灼烧的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是_______(填选项)。A. | B. | C. | D. |
(3)氧化铁是重要工业颜料,煅烧
 可得到此颜料。写出在空气中煅烧
可得到此颜料。写出在空气中煅烧 的化学方程式
的化学方程式(4)向含有
 和
和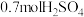 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知一开始加铁粉的反应为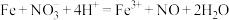 )。
)。
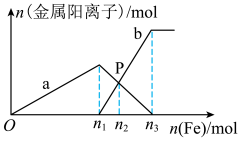
①a表示的是
②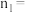
③向P点溶液中加入铜粉,最多可溶解铜粉的质量是
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
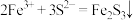 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
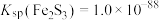 ,
,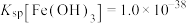 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:Ⅰ 我国古代四大发明之一的黑火药足由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时发生的反应为:
 。请回答:
。请回答:(1)X的化学式是
(2)在上述反应中,还原产物是(填化学式)
Ⅱ 磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)都是重要的化工产品。
(3)已知:1 mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3 mol、2 mol、1 mol。则Na2HPO4、NaH2PO2、Na2HPO3中属于酸式盐的是
(4)NaHSO4可用作清洁剂、防腐剂等。下列关于NaHSO4的说法正确的是
a.NaHSO4固体不能导电
b.NaHSO4溶液的导电性一定强于CH3COOH溶液
c.NaHSO4属于电解质
d.NaHSO4溶液显中性
Ⅲ 实验室中需0.2 mol/L的Na2CO3溶液80 mL,请回答下列问题。
(5)配制上述溶液所需的
(6)实验时下图所示操作的先后顺序为

(7)取用任意体积的该Na2CO3溶液时,下列物理量不随所取体积的多少而变化的是
a.溶液中Na2CO3的物质的量 b.溶液的浓度
c.溶液中
 的数目 d.溶液的密度
的数目 d.溶液的密度



