解题方法
1 . 下列离子方程式与实验对应正确的是
| 选项 | 实验 | 离子方程式 |
| A | 向Na2S2O3溶液中加入稀硝酸 | S2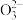 +2H+=SO2↑+S↓+H2O +2H+=SO2↑+S↓+H2O |
| B | 用K3[Fe(CN)6]溶液检测FeCl2溶液中的Fe2+ | 2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2↓ |
| C | 向NH4Al(SO4)2溶液中滴加过量NaOH溶液 | N +Al3++4OH-=NH3·H2O+Al(OH)3↓ +Al3++4OH-=NH3·H2O+Al(OH)3↓ |
| D | 向K2MnO4溶液(墨绿色)中加入适量醋酸 溶液变为紫色且有黑色沉淀生成 | 3Mn +4H+=2Mn +4H+=2Mn +MnO2↓+2H2O +MnO2↓+2H2O |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 某化学小组制取无水三氯化铁并研究其与铜的反应,设计如下实验。
Ⅰ.制备无水三氯化铁实验装置如图:(已知:无水三氯化铁易潮解,100℃左右升华)_____ 。
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是_____ 。
(3)实验中D与E装置间采用大的导管连接的目的是_____ 。
(4)F装置所装溶液目的是_____ 。
(5)此装置存在明显的缺陷,你的改进方案是_____ 。
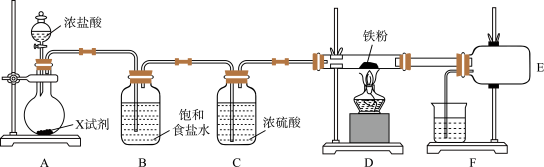
Ⅱ.探究三氯化铁与铜反应的实验如图:(已知: 中的C为
中的C为 价)
价)_____ 。
(7)为了进一步研究白色沉淀,进行如图实验:_____ (填化学式)。
②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成 、
、 、
、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为_____ 。
Ⅰ.制备无水三氯化铁实验装置如图:(已知:无水三氯化铁易潮解,100℃左右升华)
(2)整个装置充满黄绿色气体后,才开始加热D装置的目的是
(3)实验中D与E装置间采用大的导管连接的目的是
(4)F装置所装溶液目的是
(5)此装置存在明显的缺陷,你的改进方案是
Ⅱ.探究三氯化铁与铜反应的实验如图:(已知:
 中的C为
中的C为 价)
价)
(7)为了进一步研究白色沉淀,进行如图实验:

②白色沉淀之一(用D表示)与过量稀硝酸反应生成白色沉淀B含有阴离子,同时生成
 、
、 、
、 气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
气体。D与硝酸反应中还原剂与氧化剂物质的量之比为
您最近半年使用:0次
2024-03-14更新
|
195次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(七)化学试题
3 . 某离子反应中涉及Mn 、S、S2-、H+、Mn2+、H2O六种粒子,反应过程中S的质量随时间变化的曲线如图所示。下列叙述正确的是
、S、S2-、H+、Mn2+、H2O六种粒子,反应过程中S的质量随时间变化的曲线如图所示。下列叙述正确的是

 、S、S2-、H+、Mn2+、H2O六种粒子,反应过程中S的质量随时间变化的曲线如图所示。下列叙述正确的是
、S、S2-、H+、Mn2+、H2O六种粒子,反应过程中S的质量随时间变化的曲线如图所示。下列叙述正确的是
A.Mn 中Mn的化合价为+6 中Mn的化合价为+6 |
| B.S2-作还原剂,得电子后生成S |
| C.根据该反应可判断还原性:S2->Mn2+ |
| D.离子方程式中氧化剂与还原剂的化学计量数之比为2∶5 |
您最近半年使用:0次
名校
4 . 利用如图的装置制备NaBiO3(铋酸钠):
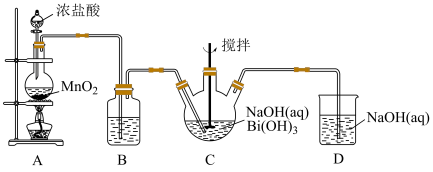
(1)A装置中反应的离子方程式:_________________ 。
(2)B装置中试剂是____________ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是________________________ 。
(4)实验完毕后,为了提高产品纯度,需要的操作有_________ 、过滤、洗涤、干燥。
(5)写出装置C中发生反应的化学方程式:_________________________ 。
(6)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是___________ 。
②结合第(3)小题C装置中的反应,分析NaBiO3和Cl2氧化性强弱不一致的主要原因是_______________ 。

| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(1)A装置中反应的离子方程式:
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)实验完毕后,为了提高产品纯度,需要的操作有
(5)写出装置C中发生反应的化学方程式:
(6)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBiO3和Cl2氧化性强弱不一致的主要原因是
您最近半年使用:0次
名校
解题方法
5 . 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
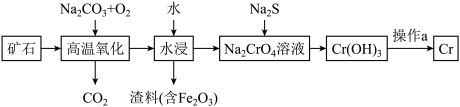
已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为______ 价。
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为_____________________ 。
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:_________________________ 。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:______________ 、____________ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:________________ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为___________ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
您最近半年使用:0次
名校
6 . 工业上以钛铁矿( ,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
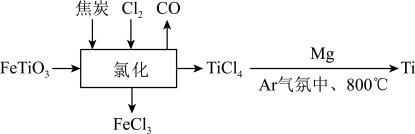

 ,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是

| A.为加快“氯化”速率,可将钛铁矿粉碎并与焦炭混合均匀 |
B.“氯化”过程发生的反应: |
| C.理论上,每制得1molTi,需要2molMg |
| D.在高温超导领域中,钛可以合成钙钛矿,其晶胞如上图(右)所示,该晶体中每个钛离子周围与它最近且相等距离的钛离子有4个 |
您最近半年使用:0次
7 . 废物利用对保护环境、节约资源和带动社会效益起着积极作用。某废旧金属材料主要为铜、铝、铁及其氧化物的混合物,利用该材料得到胆矾的一种流程如下:
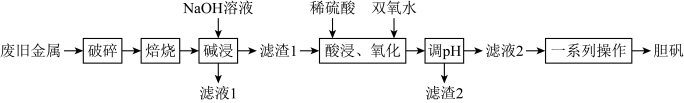
已知:调pH可将Fe2+与Cu2+分离,但不易将Fe2+与Cu2+分离。
请回答下列问题:
(1)流程中“粉碎”的目的是___________ 。
(2)“碱浸”时发生反应的离子方程式为___________ 。
(3)“酸浸”后“氧化”时发生反应的离子方程式为___________ ;该过程温度不宜过高,原因为___________ 。
(4)“滤渣2”的成分为___________ (填化学式);“一系列操作”不能采用直接蒸发结晶的原因为___________ 。
(5)有同学从上述流程中的“氧化”和“调pH”联想到过氧化钠也具有氧化性,且与水反应能生成氢氧化钠。于是向硫酸亚铁溶液中加入一定量的过氧化钠固体,观察到有红褐色固体产生且无气体生成。若过氧化钠与硫酸亚铁反应的物质的量之比为1:2,则该反应的离子方程式为___________ 。

已知:调pH可将Fe2+与Cu2+分离,但不易将Fe2+与Cu2+分离。
请回答下列问题:
(1)流程中“粉碎”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸”后“氧化”时发生反应的离子方程式为
(4)“滤渣2”的成分为
(5)有同学从上述流程中的“氧化”和“调pH”联想到过氧化钠也具有氧化性,且与水反应能生成氢氧化钠。于是向硫酸亚铁溶液中加入一定量的过氧化钠固体,观察到有红褐色固体产生且无气体生成。若过氧化钠与硫酸亚铁反应的物质的量之比为1:2,则该反应的离子方程式为
您最近半年使用:0次
名校
解题方法
8 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
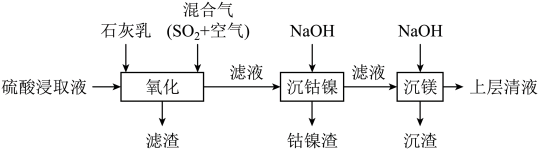
已知:
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为___________ 。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为:___________ ;得到滤渣的主要成分为 、
、___________ (填化学式)。
(3)“沉钴镍”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(4)“沉镁”中为使 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于___________ (精确至0.1)。
(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
(6) 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  |  |  | 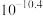 |
(1)基态Co原子的价层电子轨道表示式为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知
 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为: 、
、(3)“沉钴镍”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:(4)“沉镁”中为使
 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
| A.粉碎矿渣、升高温度均可以提高“溶浸”率 |
B.通过高温焙烧可以将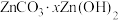 制得氧化锌 制得氧化锌 |
C.根据 中S的化合价分析, 中S的化合价分析, 具有强还原性 具有强还原性 |
D. 可与浓盐酸反应生成 可与浓盐酸反应生成 , , 参与反应可生成 参与反应可生成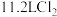 |
(6)
 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是
您最近半年使用:0次
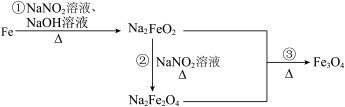
9 . 发蓝工艺是一种材料保护技术,钢铁零件的发蓝处理实质是使钢铁表面通过氧化反应,生成有一定厚度、均匀、致密、附着力强、耐腐蚀性能好的深蓝色氧化膜。钢铁零件经历如图转化进行发蓝处理,已知 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是
 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是
A.钢铁零件发蓝处理所得的深蓝色氧化膜是 |
| B.反应①中氧化剂和还原剂的物质的量之比为3∶1 |
C.反应②的离子方程式为 |
| D.反应③属于氧化还原反应 |
您最近半年使用:0次
名校
10 . 下列有关描述对应的离子方程式书写正确的是
A.食醋除去瓶胆内的水垢: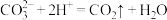 |
B.碳酸氢钙溶液与过量的澄清石灰水混合: |
C.向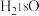 中投入 中投入 固体: 固体: |
D.乙醇被酸性 溶液氧化成乙酸: 溶液氧化成乙酸: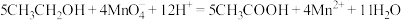 |
您最近半年使用:0次



