名校
1 . 高锰酸钾溶液常用于物质的分析与检验。
(1)实验室欲配制: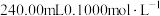 的
的 溶液。
溶液。
①配制上述溶液需用到容量瓶的规格为_______ (填“50”、“250”或500)mL。
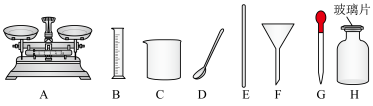
②配制上述溶液一定不需要用到下列仪器中的______ (填字母)。
③下列操作可能导致所配溶液浓度偏大的是_______ (填字母)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后,没有洗涤烧杯
(2)用 溶液可以测定
溶液可以测定 溶液中
溶液中 的浓度,发生反应为
的浓度,发生反应为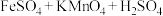
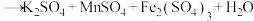 。配平该反应:
。配平该反应:________ 。
(3)称取0.90g草酸( )溶于稀硫酸,向其中滴加
)溶于稀硫酸,向其中滴加 溶液,恰好完全反应时消耗
溶液,恰好完全反应时消耗 的
的 溶液
溶液 ,
, 被还原为
被还原为 ,则
,则 的氧化产物为
的氧化产物为_______ (填化学式)。
(4)下列生活中的现象不属于氧化还原反应的是________(填字母)。
(1)实验室欲配制:
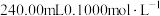 的
的 溶液。
溶液。①配制上述溶液需用到容量瓶的规格为
②配制上述溶液一定不需要用到下列仪器中的

③下列操作可能导致所配溶液浓度偏大的是
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后,没有洗涤烧杯
(2)用
 溶液可以测定
溶液可以测定 溶液中
溶液中 的浓度,发生反应为
的浓度,发生反应为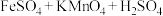
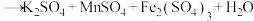 。配平该反应:
。配平该反应:(3)称取0.90g草酸(
 )溶于稀硫酸,向其中滴加
)溶于稀硫酸,向其中滴加 溶液,恰好完全反应时消耗
溶液,恰好完全反应时消耗 的
的 溶液
溶液 ,
, 被还原为
被还原为 ,则
,则 的氧化产物为
的氧化产物为(4)下列生活中的现象不属于氧化还原反应的是________(填字母)。
| A.煤气燃烧 | B.高炉炼铁 |
| C.食醋除去水壶中的水垢 | D.植物光合作用 |
您最近半年使用:0次
名校
2 . 氧化还原反应与生产、生活密切相关。
(1)为有效防止新冠病毒的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精( 的乙醇溶液)以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备
的乙醇溶液)以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备 有三种常用方法:
有三种常用方法:
a.
b.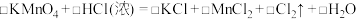
c.
①常温下,医用酒精、 、
、 固体、
固体、 固体、浓盐酸中,能导电的是
固体、浓盐酸中,能导电的是_______________ ,属于电解质的是_______________________ 。
②写出反应c对应的离子方程式:______________ [已知 (浓)可拆分为
(浓)可拆分为 和
和 ]。
]。
③配平反应b的方程式:____________________ 。
④若要制得相同质量的氯气,a、c反应中电子转移的数目之比为__________ 。
(2)法律规定小规模食品生产经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。实验室中,亚硝酸钠 可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.
b.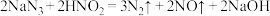
上述两个反应中,属于氧化还原反应的是___________ (填“a”或“b”)。用双线桥法表示该氧化还原反应中电子转移的方向和数目:______________________________________ 。
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中 转化为
转化为 而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于中毒、解毒过程的说法中,正确的是
而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于中毒、解毒过程的说法中,正确的是___________ (填字母)。
a.亚硝酸钠是还原剂 b.维生素C是氧化剂
c.维生素C能把 还原为
还原为 d.亚硝酸钠被还原
d.亚硝酸钠被还原
②含 的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠,反应生成一种无毒且空气中含量最多的气体,写出该反应的离子方程式:
的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠,反应生成一种无毒且空气中含量最多的气体,写出该反应的离子方程式:_______________________ 。
(1)为有效防止新冠病毒的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精(
 的乙醇溶液)以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备
的乙醇溶液)以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备 有三种常用方法:
有三种常用方法:a.

b.
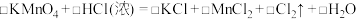
c.

①常温下,医用酒精、
 、
、 固体、
固体、 固体、浓盐酸中,能导电的是
固体、浓盐酸中,能导电的是②写出反应c对应的离子方程式:
 (浓)可拆分为
(浓)可拆分为 和
和 ]。
]。③配平反应b的方程式:
④若要制得相同质量的氯气,a、c反应中电子转移的数目之比为
(2)法律规定小规模食品生产经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。实验室中,亚硝酸钠
 可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
可用来处理过量的叠氮化钠,有关反应的化学方程式如下:a.

b.
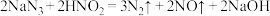
上述两个反应中,属于氧化还原反应的是
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中
 转化为
转化为 而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于中毒、解毒过程的说法中,正确的是
而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于中毒、解毒过程的说法中,正确的是a.亚硝酸钠是还原剂 b.维生素C是氧化剂
c.维生素C能把
 还原为
还原为 d.亚硝酸钠被还原
d.亚硝酸钠被还原②含
 的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠,反应生成一种无毒且空气中含量最多的气体,写出该反应的离子方程式:
的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠,反应生成一种无毒且空气中含量最多的气体,写出该反应的离子方程式:
您最近半年使用:0次
名校
3 . 二氧化氯( )消毒剂是国际上公认的高效消毒灭菌剂,可以杀灭一切微生物。二氧化氯常温下为黄绿色或枯黄色气体,以下是二氧化氯的几种工业制备方法。
)消毒剂是国际上公认的高效消毒灭菌剂,可以杀灭一切微生物。二氧化氯常温下为黄绿色或枯黄色气体,以下是二氧化氯的几种工业制备方法。
(1) 还原法:
还原法: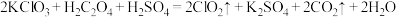 ,请用双线桥表示该反应电子转移的方向和数目
,请用双线桥表示该反应电子转移的方向和数目_______ 。
(2) 还原法:(
还原法:( 和
和 以物质的量之比
以物质的量之比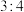 进行反应)
进行反应)
①配平该反应的离子方程式:_______ 。
_______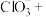 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
②还原产物为_______ 。
(3)盐酸法: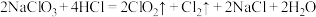 ;当
;当 参加反应时,做酸性介质的HCl的物质的量为
参加反应时,做酸性介质的HCl的物质的量为_______ mol。
(4) 自氧化法:
自氧化法: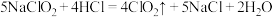 ;该反应中,氧化剂与还原剂的物质的量之比为
;该反应中,氧化剂与还原剂的物质的量之比为_______ ,若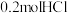 参加反应,则转移的电子数为
参加反应,则转移的电子数为_______ 。
 )消毒剂是国际上公认的高效消毒灭菌剂,可以杀灭一切微生物。二氧化氯常温下为黄绿色或枯黄色气体,以下是二氧化氯的几种工业制备方法。
)消毒剂是国际上公认的高效消毒灭菌剂,可以杀灭一切微生物。二氧化氯常温下为黄绿色或枯黄色气体,以下是二氧化氯的几种工业制备方法。(1)
 还原法:
还原法: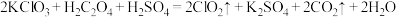 ,请用双线桥表示该反应电子转移的方向和数目
,请用双线桥表示该反应电子转移的方向和数目(2)
 还原法:(
还原法:( 和
和 以物质的量之比
以物质的量之比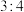 进行反应)
进行反应)①配平该反应的离子方程式:
_______
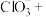 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
②还原产物为
(3)盐酸法:
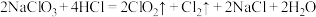 ;当
;当 参加反应时,做酸性介质的HCl的物质的量为
参加反应时,做酸性介质的HCl的物质的量为(4)
 自氧化法:
自氧化法: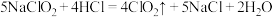 ;该反应中,氧化剂与还原剂的物质的量之比为
;该反应中,氧化剂与还原剂的物质的量之比为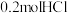 参加反应,则转移的电子数为
参加反应,则转移的电子数为
您最近半年使用:0次
名校
4 . 双碱法脱硫过程如图所示。下列说法不正确的是
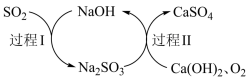

A.过程Ⅰ中, 未被氧化 未被氧化 |
B.过程Ⅱ中, 可氧化 可氧化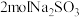 |
C.双碱法脱硫过程中, 是催化剂, 是催化剂, 可以循环利用 可以循环利用 |
D.总反应为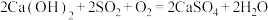 |
您最近半年使用:0次
名校
5 . 滴定是一种重要的定量实验方法。现拟用KMnO4溶液去测定市场上售卖的草酸的纯度,步骤如下:(已知:M(H2C2O4)=90g·mol-1)
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___________ 。
(2)滴定时盛装KMnO4标准溶液所用仪器为___________ 。
(3)由如图可知消耗KMnO4溶液体积为___________ mL。

(4)滴定终点的现象为___________ 。
(5)通过上述数据,求得草酸的纯度为___________ 。(精确度保留到0.1)
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果___________ (偏大、偏小或无影响,下同);
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果___________ ;
③滴定前有气泡,滴定后气泡消失,引起实验结果___________ ;
④滴定前正确读数,滴定后俯视,引起实验结果___________ 。
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式
(2)滴定时盛装KMnO4标准溶液所用仪器为
(3)由如图可知消耗KMnO4溶液体积为

(4)滴定终点的现象为
(5)通过上述数据,求得草酸的纯度为
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果
③滴定前有气泡,滴定后气泡消失,引起实验结果
④滴定前正确读数,滴定后俯视,引起实验结果
您最近半年使用:0次
解题方法
6 . 某实验小组对一种染料废水进行处理,获得Na2SO4并测定废水的总有机碳(总有机碳是指单位体积水样中溶解或悬浮的有机物碳元素质量总和,是水体评价的综合指标之一)。
实验步骤为:
①取100mL废水(假定有机成分只有萘磺酸钠),在35℃下加入等体积甲醇,充分混合后,冷却、过滤,得到固体A和滤液B。
②经检测,固体A主要成分为Na2SO4,并含有少量Na2SO3和萘磺酸钠;滤液B含2.3g萘磺酸钠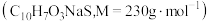 。
。
③一定温度下,从滤液B中回收甲醇;再蒸发浓缩析出萘磺酸钠,过滤,得滤液C,向滤液C中加入适量的NaClO溶液去除少量的 和NH3。
和NH3。
④按下图实验装置(部分装置略)对固体A进行处理,完全反应后Pt坩埚中固体为Na2SO4。
回答下列问题:
(1)实验步骤①中加入甲醇的目的为_______ 。
(2)实验步骤③中回收甲醇的操作名称是_______ ,去除NH3生成N2反应的离子方程式为_______ 。
(3)通入N2的目的是_______ 。
(4)酸性KMnO4溶液的作用是_______ ,试剂 是
是_______ 。
(5)改为通入O2前,需_______(填标号)。
(6)反应后U形管(含试剂)增重0.44g,该废水总有机碳=_______  (用科学记数法表示)。
(用科学记数法表示)。
实验步骤为:
①取100mL废水(假定有机成分只有萘磺酸钠),在35℃下加入等体积甲醇,充分混合后,冷却、过滤,得到固体A和滤液B。
②经检测,固体A主要成分为Na2SO4,并含有少量Na2SO3和萘磺酸钠;滤液B含2.3g萘磺酸钠
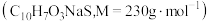 。
。③一定温度下,从滤液B中回收甲醇;再蒸发浓缩析出萘磺酸钠,过滤,得滤液C,向滤液C中加入适量的NaClO溶液去除少量的
 和NH3。
和NH3。④按下图实验装置(部分装置略)对固体A进行处理,完全反应后Pt坩埚中固体为Na2SO4。
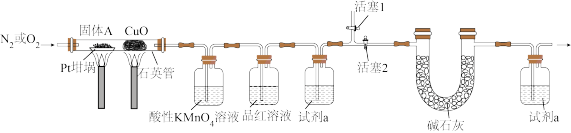
回答下列问题:
(1)实验步骤①中加入甲醇的目的为
(2)实验步骤③中回收甲醇的操作名称是
(3)通入N2的目的是
(4)酸性KMnO4溶液的作用是
 是
是(5)改为通入O2前,需_______(填标号)。
| A.打开活塞1 | B.打开活塞2 | C.关闭活塞1 | D.关闭活塞2 |
(6)反应后U形管(含试剂)增重0.44g,该废水总有机碳=
 (用科学记数法表示)。
(用科学记数法表示)。
您最近半年使用:0次
2024-01-20更新
|
961次组卷
|
5卷引用:2024届陕西省宝鸡市高三下学期三模考试理科综合试题-高中化学
2024届陕西省宝鸡市高三下学期三模考试理科综合试题-高中化学2024年1月河南普通高等学校招生考试适应性测试化学试题(已下线)T27-实验综合题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升(已下线)热点22 定量分析型实验综合题
名校
7 .  具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
Ⅰ.下列是制备 的一种流程:
的一种流程:
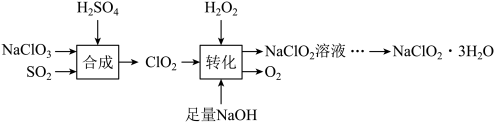
已知: 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ 。若生成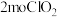 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”),写出反应的化学方程式是___________ 。
(3)由 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到 产品。
产品。
Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取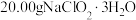 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的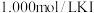 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用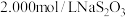 溶液滴定至终点。
溶液滴定至终点。
步骤3:重复以上操作2-3次测得滴定 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。
已知: ,
,
(4)试计算该 样品的纯度
样品的纯度___________ 。
 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。Ⅰ.下列是制备
 的一种流程:
的一种流程:
已知:
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。(1)写出“合成”中发生反应的离子方程式:
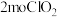 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中
 的作用是
的作用是(3)由
 溶液得到
溶液得到 的操作为:蒸发浓缩,
的操作为:蒸发浓缩, 产品。
产品。Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取
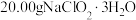 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的
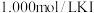 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用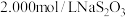 溶液滴定至终点。
溶液滴定至终点。步骤3:重复以上操作2-3次测得滴定
 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。已知:
 ,
,
(4)试计算该
 样品的纯度
样品的纯度
您最近半年使用:0次
名校
解题方法
8 . 吸入氧气、排出二氧化碳,在遥远的太空中并不容易,因为在航天服、航天器、空间站等密闭系统中, 浓度会高得多,因此必须通过一定方法将
浓度会高得多,因此必须通过一定方法将 清除。回答下列问题:
清除。回答下列问题:
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂 吸附
吸附 生成碳酸锂。吸附时发生反应的化学方程式为
生成碳酸锂。吸附时发生反应的化学方程式为__________ 。采用 而不用
而不用 的原因是
的原因是__________ 。航天器返回地面后,用氢氧化钙与碳酸锂反应使 再生,该反应的化学方程式为
再生,该反应的化学方程式为__________ 。
(2)以固态胺作为吸附剂,吸附 与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出
与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出 ,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是__________ (填“化学”或“物理”)变化。
(3)早期空间站内 可用超氧化钾
可用超氧化钾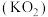 吸收,该反应的化学方程式为
吸收,该反应的化学方程式为__________ 。
(4)如今,空间站利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如图所示:
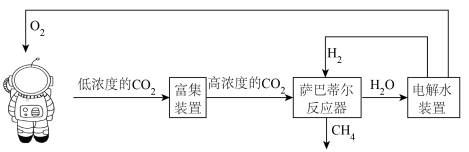
①该流程的总反应方程式为__________ 。
②从元素转化角度来看,上述流程中萨巴蒂尔反应的缺点是__________ 。
 浓度会高得多,因此必须通过一定方法将
浓度会高得多,因此必须通过一定方法将 清除。回答下列问题:
清除。回答下列问题:(1)我国“飞天”舱外航天服采用非再生式氢氧化锂
 吸附
吸附 生成碳酸锂。吸附时发生反应的化学方程式为
生成碳酸锂。吸附时发生反应的化学方程式为 而不用
而不用 的原因是
的原因是 再生,该反应的化学方程式为
再生,该反应的化学方程式为(2)以固态胺作为吸附剂,吸附
 与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出
与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出 ,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是(3)早期空间站内
 可用超氧化钾
可用超氧化钾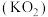 吸收,该反应的化学方程式为
吸收,该反应的化学方程式为(4)如今,空间站利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如图所示:

①该流程的总反应方程式为
②从元素转化角度来看,上述流程中萨巴蒂尔反应的缺点是
您最近半年使用:0次
解题方法
9 . 工业上以铬铁矿(主要成分FeO·Cr2O3,含Al2O3、SiO2等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如图a。回答下列问题:

(1)“焙烧”时,将矿料磨碎且气体与矿料逆流而行,其目的是
(2)“焙烧”的目的是将FeO·Cr2O3转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐,写出焙烧时FeO·Cr2O3发生的化学方程式
(3)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图b所示。当溶液中可溶组分浓度c≤1.0×10-5mol/L时,可认为已除尽。

试分析:“中和”时pH的理论范围为
(4)蒸发结晶步骤中的副产品主要是
(5)此方法生产过程中会产生大量含
 的酸性废水,可以用如图c装置处理。向废水中加入适量的NaCl进行电解,
的酸性废水,可以用如图c装置处理。向废水中加入适量的NaCl进行电解, 被电极产物还原为Cr2+,然后生成Cr(OH)3沉淀除去,废水则可以达到排放标准。
被电极产物还原为Cr2+,然后生成Cr(OH)3沉淀除去,废水则可以达到排放标准。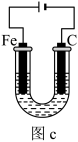
①写出阳极的电极方程式
②已知Ksp[Cr(OH)3]=1.0×10-32,若电解一段时间后,调节pH测得溶液中c(Fe3+)=1.0×10-12mol/L,则此时c(Cr3+)=
您最近半年使用:0次
名校
解题方法
10 . 铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液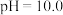 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示:
②萃取的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
请回答下列问题:
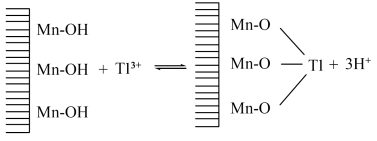
(1)“反应”步骤中总反应的离子方程式为___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是___________ 。
(3)请从化学平衡的角度解释“反萃取”过程中加入 的原理和目的
的原理和目的___________ 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液 的范围为
的范围为___________ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为___________ 。
(5)废水中 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为___________ (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收 ,可将离子交换树脂浸入
,可将离子交换树脂浸入___________ 溶液。
a. b.
b. c.
c.
 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: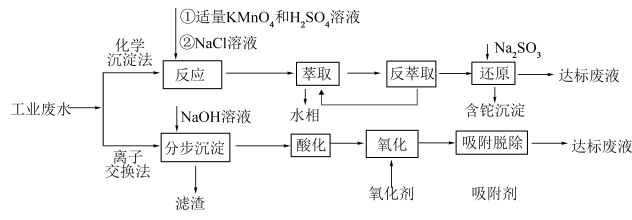
 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液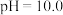 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示: | 离子 |  |  |  |
开始沉淀的 | 2.7 | 6.4 | 1.4 |
沉淀完全的 | 3.7 | 8.0 | 2.8 |

 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为
(2)“滤渣”的主要成分是
(3)请从化学平衡的角度解释“反萃取”过程中加入
 的原理和目的
的原理和目的(4)“分步沉淀”时,沉淀第二种离子时调节溶液
 的范围为
的范围为(5)废水中
 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为 ,可将离子交换树脂浸入
,可将离子交换树脂浸入a.
 b.
b. c.
c.
您最近半年使用:0次
2024-01-13更新
|
835次组卷
|
4卷引用:2024届陕西省西安中学高三下学期三模理综试题-高中化学
2024届陕西省西安中学高三下学期三模理综试题-高中化学山东省济宁市2023-2024学年高三上学期1月期末化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)T27-工业流程题



