名校
1 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠( )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。
(1)与基态铬原子的最外层电子数相同且同周期的元素有_________ 种。
(2)为了提高“焙烧”效果,可采取的一种措施是____________ 。
(3)“浸取”所得的滤渣为 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[ ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度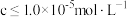 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为________ ;“酸化”过程中的离子方程式为____________ 。 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。
①若电解后溶液中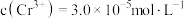 ,则
,则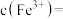
__________  {已知
{已知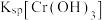
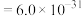 ,
,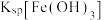 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。
②电解法处理含 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是_________ (填标号)。
A.阳极反应为
B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol 被还原
被还原
 )的工艺流程如下图。已知:①
)的工艺流程如下图。已知:① 中Cr的化合价为+3;②焙烧的目的是将
中Cr的化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将Al、Si氧化物转化为可溶性钠盐。
,并将Al、Si氧化物转化为可溶性钠盐。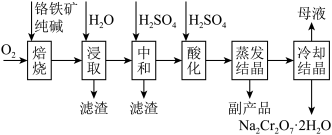
(1)与基态铬原子的最外层电子数相同且同周期的元素有
(2)为了提高“焙烧”效果,可采取的一种措施是
(3)“浸取”所得的滤渣为
 由此推断
由此推断 “焙烧”时发生主要反应的化学方程式为
“焙烧”时发生主要反应的化学方程式为(4)常温下,矿物中相关元素可溶性组分物质的量浓度的对数[
 ]与pH的关系如图所示。当溶液中可溶性组分浓度
]与pH的关系如图所示。当溶液中可溶性组分浓度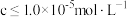 时,可认为已除尽。则“中和”时pH的理论范围为
时,可认为已除尽。则“中和”时pH的理论范围为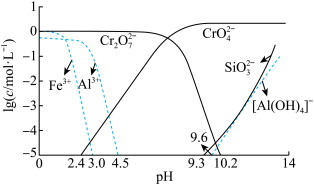
 的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生 和
和 沉淀。
沉淀。①若电解后溶液中
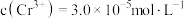 ,则
,则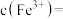
 {已知
{已知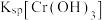
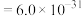 ,
,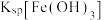 可从第(4)小题图中计算得出}。
可从第(4)小题图中计算得出}。②电解法处理含
 的酸性废水,下列有关原理的说法正确的是
的酸性废水,下列有关原理的说法正确的是A.阳极反应为

B.电解过程中溶液pH不会变化
C.如果石墨作阳极,电解过程不变
D.电路中每转移12mol电子,阳极有1mol
 被还原
被还原
您最近一年使用:0次
名校
2 . 利用某钒废渣(主要成分为 以及铁、铝、硅的氧化物)制备
以及铁、铝、硅的氧化物)制备 的工艺流程如图。
的工艺流程如图。 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;
Ⅱ. (有机层)
(有机层)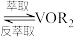 (有机层)
(有机层) ;
;
Ⅲ.溶液中 与
与 可相互转化:
可相互转化: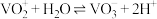 。
。
下列说法错误的是
 以及铁、铝、硅的氧化物)制备
以及铁、铝、硅的氧化物)制备 的工艺流程如图。
的工艺流程如图。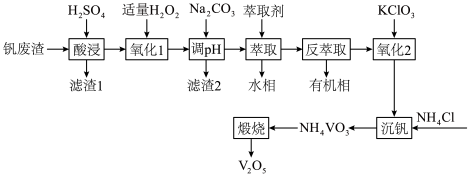
 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;Ⅱ.
 (有机层)
(有机层)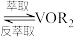 (有机层)
(有机层) ;
;Ⅲ.溶液中
 与
与 可相互转化:
可相互转化: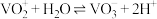 。
。下列说法错误的是
| A.“氧化1”中,不适宜用升温的方式加快转化速率 |
B.“滤渣2”的成分为 |
| C.有机萃取剂可循环使用 |
D.“沉钒”时还需通 调节溶液的酸碱性 调节溶液的酸碱性 |
您最近一年使用:0次
7日内更新
|
406次组卷
|
3卷引用:2024届湖南省湖南大学附属中学高三下学期二模 化学试题
2024届湖南省湖南大学附属中学高三下学期二模 化学试题 (已下线)江苏省姜堰中学、如东中学、前黄中学三校2023-2024学年高三下学期联考化学试题福建省福州市八县市一中2024届高三下学期模拟联考化学试题
3 .  难溶于水,25℃时,不同
难溶于水,25℃时,不同 的溶液中含铅物种存在以下平衡:
的溶液中含铅物种存在以下平衡:
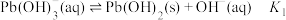 ;
;
 ;
;
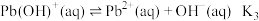 。
。
如图是溶液中各含铅物种的 图。下列说法错误的是
图。下列说法错误的是
 难溶于水,25℃时,不同
难溶于水,25℃时,不同 的溶液中含铅物种存在以下平衡:
的溶液中含铅物种存在以下平衡: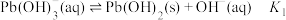 ;
; ;
;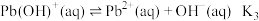 。
。如图是溶液中各含铅物种的
 图。下列说法错误的是
图。下列说法错误的是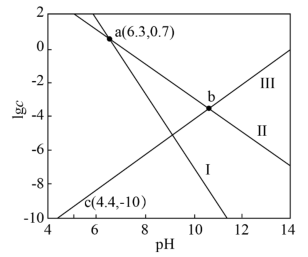
A.直线I和Ⅲ分别表示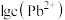 与 与 与 与 的变化关系 的变化关系 |
B. 的平衡常数K的数量级是 的平衡常数K的数量级是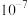 |
C. 饱和溶液的 饱和溶液的 |
D.b点对应溶液的 为10.7 为10.7 |
您最近一年使用:0次
7日内更新
|
161次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
名校
解题方法
4 . 下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将 固体粉末加入过量 固体粉末加入过量 溶液中,充分搅拌,溶解得到无色溶液 溶液中,充分搅拌,溶解得到无色溶液 |  既体现碱性又体现酸性 既体现碱性又体现酸性 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量粉MgO末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| D | 检验某有机物( | 该有机物中含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024·河南·二模
5 . 298K时,用NaOH溶液分别滴定等物质的量浓度的HR、 、
、 三种溶液。pM[p表示负对数,M表示
三种溶液。pM[p表示负对数,M表示 、
、 、
、 ]随溶液pH变化的关系如图所示。
]随溶液pH变化的关系如图所示。 ,当离子浓度
,当离子浓度 时,该离子完全沉淀。
时,该离子完全沉淀。
下列推断正确的是
 、
、 三种溶液。pM[p表示负对数,M表示
三种溶液。pM[p表示负对数,M表示 、
、 、
、 ]随溶液pH变化的关系如图所示。
]随溶液pH变化的关系如图所示。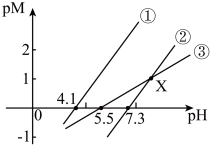
 ,当离子浓度
,当离子浓度 时,该离子完全沉淀。
时,该离子完全沉淀。下列推断正确的是
A.①代表滴定 溶液的变化关系 溶液的变化关系 |
B.调节pH=5时,溶液中 完全沉淀 完全沉淀 |
C.滴定HR溶液至X点时,溶液中: |
D.经计算, 能完全溶于HR溶液 能完全溶于HR溶液 |
您最近一年使用:0次
7日内更新
|
211次组卷
|
3卷引用:湖南师大附中2024届高三下学期第三次模拟考试化学试题
名校
6 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以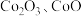 的形式存在,还含有
的形式存在,还含有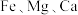 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②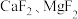 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“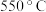 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知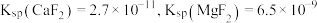 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中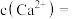
_________ (保留3位有效数字)。
(6)钴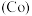 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以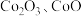 的形式存在,还含有
的形式存在,还含有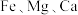 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: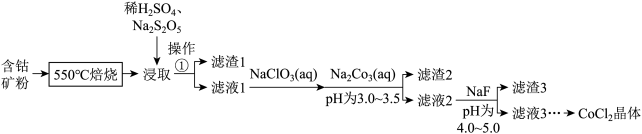
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
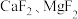 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
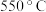 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
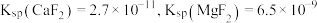 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中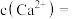
(6)钴
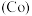 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。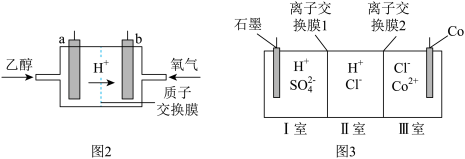
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
7 . 在20℃时,用0.5
 溶液滴定25mL 0.25
溶液滴定25mL 0.25
 溶液,加入的
溶液,加入的 溶液体积与溶液pH变化曲线如图所示,其中
溶液体积与溶液pH变化曲线如图所示,其中 时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的
时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的 溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述正确的是
溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述正确的是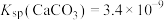 ,
,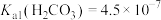 ,
,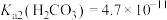 。
。

 溶液滴定25mL 0.25
溶液滴定25mL 0.25
 溶液,加入的
溶液,加入的 溶液体积与溶液pH变化曲线如图所示,其中
溶液体积与溶液pH变化曲线如图所示,其中 时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的
时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的 溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述正确的是
溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述正确的是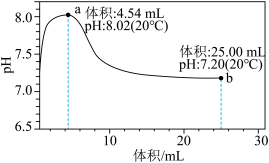
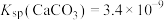 ,
,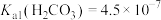 ,
,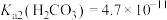 。
。A.a点的混合溶液: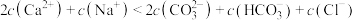 |
| B.a→b的过程中,水的电离程度不断增大 |
C.总反应的化学方程式: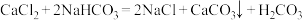 |
D.b点的混合溶液,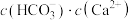 的数量级为 的数量级为 |
您最近一年使用:0次
2024·辽宁·三模
名校
解题方法
8 . 黄铁矿(主要成分FeS2)在空气中会被缓慢氧化,过程如图所示。下列说法正确的是

| A.发生反应a时,每0.2molFeS2被还原,转移2.8mole- |
B.25℃时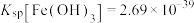 ,则该温度下d的逆反应平衡常数 ,则该温度下d的逆反应平衡常数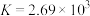 |
C.c发生反应的离子方程式为: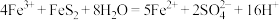 |
| D.黄铁矿是工业制备硫酸的必选原料 |
您最近一年使用:0次
7日内更新
|
182次组卷
|
3卷引用:湖南师大附中2024届高三下学期第三次模拟考试化学试题
(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题 辽宁省部分高中2023-2024学年高三下学期第三次模拟考试化学试题辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
名校
9 . 铊(Tl)广泛用于电子、军工、航天、化工、治金、通讯等方面,一种以红铊矿(主要成分是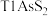 ,含少量
,含少量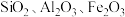 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。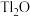 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。
②TlCl难溶于水,而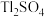 溶于水。
溶于水。
③溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是_______ 。(填元素符号)
(2)“焙烧1”中, 最终转化为
最终转化为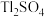 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为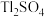 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。
第一步( 与
与 反应):
反应):
第二步:_______ 。
(3)滤渣的成分 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有_______ 个原子。
(4)“沉铊”步骤中,需要加入过量 ,其原因是
,其原因是_______ 。(用化学用语和简要的文字解释)
(5)向“沉铊”后的滤液中加入生石灰至 时才能外排,此时滤液中的
时才能外排,此时滤液中的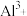 浓度为
浓度为_______  。(指数允许是小数)
。(指数允许是小数)
(6)“焙烧2”中发生的反应为 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为_______ 。
(7)所得产品高纯铊应保存在_______ 中。
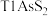 ,含少量
,含少量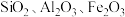 ,等杂质)为原料制备金属铊的流程如图所示。
,等杂质)为原料制备金属铊的流程如图所示。
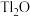 )膜,而失去金属光泽变得灰暗。
)膜,而失去金属光泽变得灰暗。②TlCl难溶于水,而
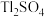 溶于水。
溶于水。③溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |
开始沉淀的 | 2.2 | 3.5 |
沉淀完全( )的 )的 | 3.2 | 4.7 |
(1)
 中三元素的基态原子含有未成对电子数最多的元素是
中三元素的基态原子含有未成对电子数最多的元素是(2)“焙烧1”中,
 最终转化为
最终转化为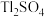 ﹔
﹔ 和
和 也转化为相应的硫酸盐。其中,
也转化为相应的硫酸盐。其中, 转化为
转化为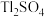 分如下两步完成。请写出第二步反应的化学方程式。
分如下两步完成。请写出第二步反应的化学方程式。第一步(
 与
与 反应):
反应):
第二步:
(3)滤渣的成分
 属于共价晶体,晶体中每个最小环含有
属于共价晶体,晶体中每个最小环含有(4)“沉铊”步骤中,需要加入过量
 ,其原因是
,其原因是(5)向“沉铊”后的滤液中加入生石灰至
 时才能外排,此时滤液中的
时才能外排,此时滤液中的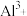 浓度为
浓度为 。(指数允许是小数)
。(指数允许是小数)(6)“焙烧2”中发生的反应为
 。则“置换”步骤中发生反应的离子方程式为
。则“置换”步骤中发生反应的离子方程式为(7)所得产品高纯铊应保存在
您最近一年使用:0次
解题方法
10 . 下列实验操作、现象和结论或解释均正确的是
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 把 通入 通入 溶液中,然后滴加氯水 溶液中,然后滴加氯水 | 先有白色沉淀产生,滴加氯水后沉淀不溶解 | 先生成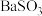 沉淀后被氧化为 沉淀后被氧化为 |
| B | 向 溶液和盐酸反应后的溶液中加入紫色石蕊试液 溶液和盐酸反应后的溶液中加入紫色石蕊试液 | 溶液变红 | 说明盐酸已经过量 |
| C | 向 溶液中通入足量的 溶液中通入足量的 | 生成两种沉淀 |  的氧化性强于S 的氧化性强于S |
| D | 向浓度均为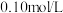 的 的 和 和 混合溶液中滴加少量 混合溶液中滴加少量 溶液 溶液 | 出现黄色沉淀 | 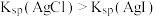 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

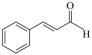 )中是否含有醛基
)中是否含有醛基



