1 . 工业生产中利用方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如下图:
晶体的工艺流程如下图: [PbCl4]2-(aq);
[PbCl4]2-(aq);
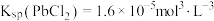 。
。
下列说法错误的是
 等杂质)制备
等杂质)制备 晶体的工艺流程如下图:
晶体的工艺流程如下图: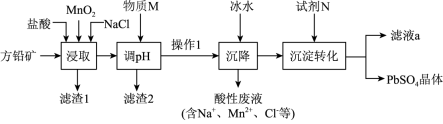
 [PbCl4]2-(aq);
[PbCl4]2-(aq);
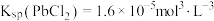 。
。下列说法错误的是
A.由该工艺可知,PbCl2(s)+2Cl-(aq)  [PbCl4]2-(aq)为吸热反应 [PbCl4]2-(aq)为吸热反应 |
| B.滤渣2的主要成分是氢氧化铁 |
C.“沉淀转化”过程达平衡时,溶液中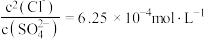 |
D.“浸取”时可发生反应: |
您最近一年使用:0次
名校
2 . 绿矾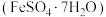 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为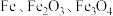 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下:
(1)“焙烧”的目的是______ 。
(2)提高“酸溶”反应速率的措施是______ (任写一条)。“反应”时发生反应的离子方程式为______ 。
(3)隔绝空气的目的是______ ;一系列操作包括______ 、干燥。
(4)“酸溶”后,若溶液中 为
为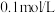 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于______  已知:
已知: 。
。
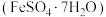 主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为
主要用于净水、照相制版及治疗缺铁性贫血等。工业上利用生活废铁(主要成分为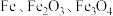 ,以及少量
,以及少量 等)制备绿矾的一种工艺流程如下:
等)制备绿矾的一种工艺流程如下: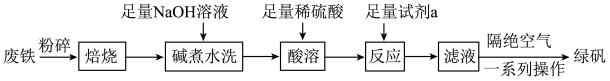
(1)“焙烧”的目的是
(2)提高“酸溶”反应速率的措施是
(3)隔绝空气的目的是
(4)“酸溶”后,若溶液中
 为
为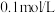 ,为了减少损失,常温下必须控制溶液的
,为了减少损失,常温下必须控制溶液的 小于
小于 已知:
已知: 。
。
您最近一年使用:0次
3 . 回答下列问题:
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度______ (填增大,减小或不变,下同),Ksp______ ,c(Ag+)______ 。
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度_______ (填“增大”、“减小”或“不变”);此时溶液中水的离子积约等于_______ 。
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:______ 所得溶液的pH______ 7(填“>”“=”或“<”),用离子方程式表示其原因:______ 。
(1)某温度下,向含有AgCl固体的AgCl饱和溶液中加入少量稀盐酸,则AgCl的溶解度
(2)现有25℃0.1mol/L的氨水。请回答以下问题:
①若向氨水中加入氯化铵固体,此时溶液中NH3•H2O电离程度
②若向氨水中加入稀硫酸,使其恰好中和,写出离子方程式:
您最近一年使用:0次
解题方法
4 . 下列实验中,对应的现象以及结论都正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下,往浓硝酸中加入铝片 | 有大量气泡产生 |  具有强氧化性 具有强氧化性 |
| B | 将某有机溶液与新制 浊液混合加热 浊液混合加热 | 有砖红色沉淀生成 | 该有机物中可能不含 |
| C | 往某无色溶液中滴加盐酸酸化的 溶液 溶液 | 有白色沉淀生成 | 原溶液中一定含 |
| D | 往 溶液中滴加5滴 溶液中滴加5滴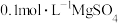 溶液,再滴加5滴 溶液,再滴加5滴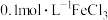 溶液 溶液 | 先有白色沉淀生成,后出现红褐色沉淀 |  的溶度积比 的溶度积比 的小 的小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 以废铁屑、低品位软锰矿[主要成分有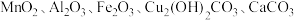 、
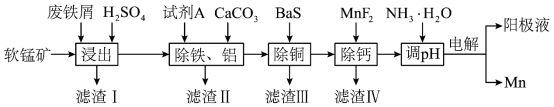
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的 如表:
如表:
Ⅱ.几种化合物的溶解性或溶度积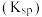 如表:
如表:
(1)基态 的价层电子排布式为
的价层电子排布式为__________ 。
(2)为去除废铁屑表面的油污可采用的方法为__________ ;“浸出”后浸出液中的 价金属阳离子有
价金属阳离子有 、
、__________ 。
(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有__________ 。
(4)“除铁、铝”过程中,浸出液需要先用试剂 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的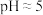 。试剂
。试剂 的作用是
的作用是__________ 。
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中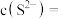
__________  。
。
(6)用惰性电极电解中性 溶液可以制得金属
溶液可以制得金属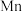 。装置如图所示。
。装置如图所示。
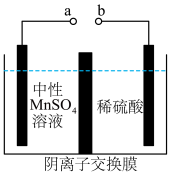
若生成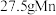 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为__________ (填“增加”或“减少”) 。
。
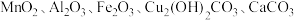 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的
 如表:
如表:| 金属阳离子 |  |  |  |  |  |
开始沉淀的 | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
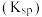 如表:
如表:| 化合物 |  | 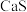 | 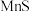 |  |  |
溶解性或溶度积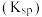 | 溶于水 | 溶于水 | 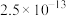 |  | 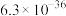 |
(1)基态
 的价层电子排布式为
的价层电子排布式为(2)为去除废铁屑表面的油污可采用的方法为
 价金属阳离子有
价金属阳离子有 、
、(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有
(4)“除铁、铝”过程中,浸出液需要先用试剂
 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的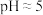 。试剂
。试剂 的作用是
的作用是(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于
 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中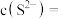
 。
。(6)用惰性电极电解中性
 溶液可以制得金属
溶液可以制得金属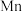 。装置如图所示。
。装置如图所示。
若生成
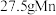 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为 。
。
您最近一年使用:0次
6 . 以高铅硫化锌原矿[主要含有ZnS,含有少量PbS、ZnCO3、SiO2、FeS、In2O3(氧化铟)等]为原料制备单质Zn的工艺流程如下:

已知:①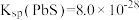 ,
,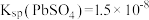 ,
,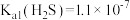 ,
,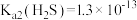 。
。
②电解液浓度过大会导致溶液粘度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是___________ ;其中杂质FeS充分焙烧产生大量废气,其主要成分的空间结构为___________ 。
(2)“滤渣I”的主要成分为___________ 和PbSO4。若撤去“焙烧”,直接“酸浸”,调节溶液中c(H+)=4.0 mol/L,若要将PbS中的Pb2+沉淀完全,试计算溶液中c(H2S)的范围___________ (保留小数点后两位)。[已知H2S饱和溶液中,c(H2S)=0.1 mol/L]。
(3)“除铁”时Fe2+转化为FeOOH的离子方程式为___________ 。
(4)“电解”硫酸锌溶液制备Zn的化学方程式为___________ ,工业所需电解液浓度为40-60 g/L的理由是___________ ,可用___________ 光谱证明阴极析出的固体为Zn。

已知:①
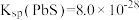 ,
,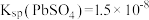 ,
,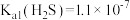 ,
,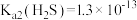 。
。②电解液浓度过大会导致溶液粘度变大,离子迁移速率低,电解效率低。
回答下列问题:
(1)“沸腾焙烧”的目的是
(2)“滤渣I”的主要成分为
(3)“除铁”时Fe2+转化为FeOOH的离子方程式为
(4)“电解”硫酸锌溶液制备Zn的化学方程式为
您最近一年使用:0次
7 . 已知 属于难溶于水、可溶于酸的盐。常温下,用
属于难溶于水、可溶于酸的盐。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中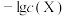 (X为
(X为 或
或 )与
)与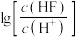 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 属于难溶于水、可溶于酸的盐。常温下,用
属于难溶于水、可溶于酸的盐。常温下,用 调节
调节 浊液的
浊液的 ,测得在不同
,测得在不同 条件下,体系中
条件下,体系中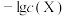 (X为
(X为 或
或 )与
)与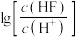 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.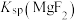 的数量级为 的数量级为 |
B. 代表 代表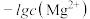 与 与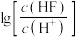 的变化曲线 的变化曲线 |
C. 、 、 两点的溶液中均存在 两点的溶液中均存在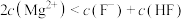 |
D. 点的溶液中存在 点的溶液中存在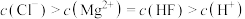 |
您最近一年使用:0次
2024-04-08更新
|
154次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高三下学期第七次月考化学试题
解题方法
8 . 由下列实验现象一定能得出相应结论的是
| 选项 | A | B | C | D |
| 装置或操作 | 在 饱和溶液中滴加稀硫酸,将产生的气体通入酸性 饱和溶液中滴加稀硫酸,将产生的气体通入酸性 溶液中 溶液中 | 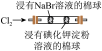 | 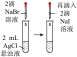 | 将带火星的木条伸入 与 与 的体积比为4∶1的混合气体中 的体积比为4∶1的混合气体中 |
| 现象 | 酸性 溶液褪色 溶液褪色 | 左边棉球变黄,右边棉球变蓝 | 试管中先出现淡黄色固体,后出现黄色固体 | 带火星的木条复燃 |
| 结论 | 该气体产物具有漂白性 | 氧化性: | 溶解度:AgCl>AgBr>AgI | 对于木条的燃烧, 比 比 的助燃效果更好 的助燃效果更好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 已知 为阿伏加德罗常数,下列关于
为阿伏加德罗常数,下列关于 说法正确的是
说法正确的是
 为阿伏加德罗常数,下列关于
为阿伏加德罗常数,下列关于 说法正确的是
说法正确的是A.标准状况下22.4L HF含有分子的个数为 |
B.1mol液态冰醋酸中含s-p  键的数目为4 键的数目为4 |
C.往 溶液中通入氯气,若有1mol 溶液中通入氯气,若有1mol  生成时,转移电子的数目可能为4 生成时,转移电子的数目可能为4 |
D.常温下已知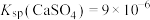 ,则该温度下 ,则该温度下 饱和溶液中含有 饱和溶液中含有 个 个 |
您最近一年使用:0次
10 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为___________ 。
(2)“酸浸”中滤渣主要成分为___________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:___________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:___________ 。
(5)“ —萘酚净化除钴”先是
—萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:___________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 。已知:
。已知: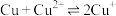
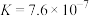 ;
;
 。请通过具体数据说明上述的反应能完全进行的原因:
。请通过具体数据说明上述的反应能完全进行的原因:___________ 。
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。 的电极方程式为
的电极方程式为___________ (x和y用具体数字表示)。
②若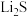 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为___________ nm。

 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
 —萘酚净化除钴”先是
—萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 。已知:
。已知: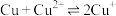
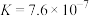 ;
;
 。请通过具体数据说明上述的反应能完全进行的原因:
。请通过具体数据说明上述的反应能完全进行的原因:(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
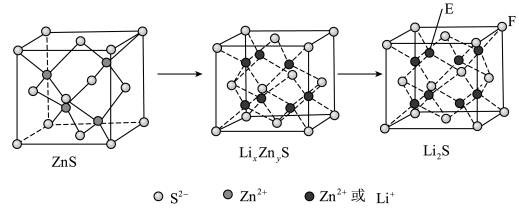
 的电极方程式为
的电极方程式为②若
 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次



