1 . 根据要求填空(所涉及元素均为前20号)
(1)A元素的原子M层有5个电子,则其原子结构示意图为__________________ ;最高价氯化物的化学式_______________________ 。
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,请写出C离子的结构示意图和电子式:________________ 、_________ 。
(3)标出下列反应的电子转移方向和数目,并填写有关内容:
KClO3+6HCl→3Cl2↑+3H2O+KCl、___________
氧化剂______________ ;氧化产物______________ ;还原剂______________ ;还原产物______________ ;被氧化的元素______________ ;HCl的作用______________ .
(1)A元素的原子M层有5个电子,则其原子结构示意图为
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,请写出C离子的结构示意图和电子式:
(3)标出下列反应的电子转移方向和数目,并填写有关内容:
KClO3+6HCl→3Cl2↑+3H2O+KCl、
氧化剂
您最近一年使用:0次
2 . 溴和氯在元素周期表中均属于___ 族。
您最近一年使用:0次
名校
3 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。完成下列填空:
(1)砷原子核外有____ 个电子层,最外层有_____ 个电子。
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列_____ (用元素符号表示)
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:_____ 强于____ (填物质的化学式)
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因______ 。
(1)砷原子核外有
(2)将砷与ⅤA族所有短周期元素的原子半径,按从小到大的顺序排列
(3)溴位于ⅦA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:
(4)周期表中,铝和砷都在金属和非金属过渡线附近。若向AlCl3溶液中逐滴加入NaOH溶液,先生成沉淀,然后沉淀逐渐消失,请用电离平衡移动的原理解释沉淀会消失的原因
您最近一年使用:0次
4 . 下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼 的是:_____ (填元素符号),原子结构示意图为_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______ ,碱性最强的化合物的电子式 是:_____________ 。
(3)用电子式表示元素④与⑥的化合物的形成过程:________ ,该化合物属于_____ (填 “共价”或“离子”)化合物。
(4)表示①与H的化合物的化学式_________________ ,该化合物是由____________ (填“极性”“非极性”)键形成的。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1)在这些元素中,化学性质
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与H的化合物的化学式
您最近一年使用:0次
5 . 砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__ 个电子层,最外层有__ 个电子,写出砷原子最外层电子的轨道表示式:__ 。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__ (用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__ 强于__ (填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__ 。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH- AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
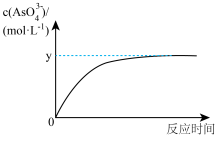
①写出该反应平衡常数的表达式K=___ 。
②不能判断反应达到平衡状态的是___ (选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
完成下列填空:
(1)砷原子核外有
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-
 AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①写出该反应平衡常数的表达式K=
②不能判断反应达到平衡状态的是
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
您最近一年使用:0次
2019-11-08更新
|
164次组卷
|
3卷引用:上海市杨浦区2017-2018学年度高三第一学期高中等级考模拟调研化学试题
上海市杨浦区2017-2018学年度高三第一学期高中等级考模拟调研化学试题上海市民星中学2019—2020学年高三上学期期中考试化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
6 . 下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请用对应的化学符号回答下列问题:

(1)D在元素周期表中的位置是____ 。
(2)E元素所形成的气态氢化物的电离方程式____ 。
(3)B、C两元素的单质较活泼的是___ 。(填元素符号)
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:___ 、___ 。
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为__ 。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为__ C表现出的性质是___ (氧化性/还原性),反应时可观察到的实验现象有___ (填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为___ ,该物质___ (填“能”或“不能”)溶于氨水,___ (填“能”或“不能”)溶于氢氧化钠溶液,若能写出发生反应的离子方程式___ 。
(7)G元素的非金属性比H元素的非金属性___ (选填“强”、“弱”),能说明这一事实的化学方程式是___ (任写一个)。

(1)D在元素周期表中的位置是
(2)E元素所形成的气态氢化物的电离方程式
(3)B、C两元素的单质较活泼的是
(4)F是形成化合物最多的一种元素,它有多种单质请写出其中的两种:
(5)C是大自然赐予人类的宝物。将少量C单质置于足量氢氧化钠溶液中,可以观察到的现象为
A.产生红棕色烟雾 B.发出耀眼的光芒 C有熔融物生成
(6)C元素的最高价氧化物对应的水化物的化学式为
(7)G元素的非金属性比H元素的非金属性
您最近一年使用:0次
7 . 下表是元素周期表的一部分。
(1)表中元素⑩的氢化物的电子式为___ ,此氢化物的还原性比元素⑨的氢化物__ (强或弱),请用一个化学方程式证明这一事实___ 。
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式___ ,并比较其酸性的强弱__ 。
(3)能生成两性氢氧化物的元素是___ ,其最高价氧化物的水化物电离方程式为__ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ② | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的电子式为
(2)分别写出⑧⑨⑩最高价氧化物对应的水化物的化学式
(3)能生成两性氢氧化物的元素是
您最近一年使用:0次
名校
8 . 如表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
(1)六种元素中,原子半径最大的是____ (填元素编号)。d、e、f三种元素的原子结构上的相同点是___ 。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是____ ;六种元素中,最高价氧化物对应水化物的酸性最强的是____ (填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_____ (选填“强”、“弱’’)。
(4)若b为非金属元素,则以下推断正确的是____ (选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
| a | b | c |
| d | e | f |
(1)六种元素中,原子半径最大的是
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性
(4)若b为非金属元素,则以下推断正确的是
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
您最近一年使用:0次
名校
9 . 下表标出的是元素周期表的一部分元素。

根据上表回答下列问题。
(1)元素①的原子序数是____ ,由元素①构成三原子单质的分子名称是____ 。
(2)元素④与⑦相比,____ 元素的原子半径较大,____ 元素的氢化物更稳定(用元素符号填写)。
(3)元素③与⑥相比,最高价氧化物对应水化物碱性较大的是________ (填碱的化学式)。
(4)元素②和⑧的氧化物常用做耐火材料。元素②的氧化物的化学式是______ ,元素⑧的氢氧化物与烧碱溶液反应的化学方程式是____________ 。
(5)如图,将潮湿的由元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是______ 。
a.稀硫酸 b.浓硫酸 c.水 d.饱和食盐水
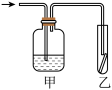

根据上表回答下列问题。
(1)元素①的原子序数是
(2)元素④与⑦相比,
(3)元素③与⑥相比,最高价氧化物对应水化物碱性较大的是
(4)元素②和⑧的氧化物常用做耐火材料。元素②的氧化物的化学式是
(5)如图,将潮湿的由元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是
a.稀硫酸 b.浓硫酸 c.水 d.饱和食盐水

您最近一年使用:0次
10 . 如表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
I.(1)这10种元素中,化学性质最不活泼的元素是____ (填元素符号,下同),非金属性最强的元素是___ 。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是_____ 。
(3)①②③三种元素的原子半径由大到小的顺序是____ 。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是____ ,有关反应的离子方程式为_____ 。
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是____ ;(填序号,下同)
(2)含有非极性键的离子化合物是____ ;
(3)不含化学键的是____ ;
(4)用电子式表示Na2O的形成过程_____ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ A | Ⅶ A | 0 |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
I.(1)这10种元素中,化学性质最不活泼的元素是
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是
(2)含有非极性键的离子化合物是
(3)不含化学键的是
(4)用电子式表示Na2O的形成过程
您最近一年使用:0次



