1 . 据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________ 周期________ 族。
(2)关于铷的结构和性质判断正确的是________ (填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________ (填序号)。
a.Li b.Na
c.K d.Cs
(1)铷(Rb)位于元素周期表的第
(2)关于铷的结构和性质判断正确的是
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是
a.Li b.Na
c.K d.Cs
您最近一年使用:0次
2020-02-04更新
|
814次组卷
|
5卷引用:2019—2020学年人教版必修2第一章 第一节《元素周期表》第2课时《元素的性质与原子结构》(跟踪训练)
2019—2020学年人教版必修2第一章 第一节《元素周期表》第2课时《元素的性质与原子结构》(跟踪训练)人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第一节 原子结构与元素周期表(已下线)练习10 元素的性质与原子结构-2020-2021学年【补习教材·寒假作业】高一化学(人教版)(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 第3节 元素周期表的应用(已下线)专题01 元素周期表【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)
2 . W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
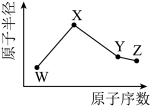
(1)Y在周期表中的位置是__ 。
(2)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是__ 。

(1)Y在周期表中的位置是
(2)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是
您最近一年使用:0次
解题方法
3 . 在下列各元素组中,除一种元素外,其余都可以按照某种共性归属为一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表中。其他元素可能归属类型:①主族元素;②过渡元素;③同周期元素;④同主族元素;⑤金属元素;⑥非金属元素。
| 元素组 | 元素组的例外元素 | 其他元素所属类型编号 |
| (1)S、Na、Mg、N | ||
| (2)N、P、Sn、As | ||
| (3)K、Ca、Al、Zn | ||
| (4)Cu、Fe、Ag、Ca |
您最近一年使用:0次
2020-01-29更新
|
109次组卷
|
2卷引用:人教版高中化学必修二第一章《物质结构 元素周期律》测试卷
4 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①________ ,⑥________ ,⑦________ ,⑪________ 。
(2)在这些元素中,最活泼的金属元素是_____ ,最活泼的非金属元素是_____ ,最不活泼的元素是________ (填元素符号)
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________ ,碱性最强的是________ ,呈两性的氢氧化物是________ ,写出三者之间相互反应的化学方程式:________________________ ;_______________________________ ; ______________________ ;
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:①
(2)在这些元素中,最活泼的金属元素是
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
您最近一年使用:0次
名校
解题方法
5 . 氟及其化合物在生产生活中被广泛使用,造福人类。
(1)氟在元素周期表中的位置是___________ 。
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式____________ 。已知25℃时,氢氟酸的电离平衡常数Ka=3.6×10-4,若将0.01 mol·L-1的HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度由大到小的顺序为_____ 。
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为_______ 。
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是________ NA。N2F4气体可用Fe3+氧化二氟胺(HNF2)制得,写出该反应的离子方程式______________ 。
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是_____________ 。
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:________ 。
(1)氟在元素周期表中的位置是
(2)氢氟酸具有刻蚀玻璃的特性,写出该反应的化学方程式
(3)次氟酸(HOF)由科学家在1971年首次制得,次氟酸的电子式为
(4)四氟肼(N2F4)用作高能燃料的氧化剂,1 mol N2F4分子中含有的共价键数目是
(5)六氟化铀(UF6)是铀的稳定气态化合物,用作核燃料,由U3O8制取UF6的三步反应原理如下:
①U3O8+H2 →UO2+H2O (未配平) ②UO2+4HF=UF4+2H2O ③UF4+ F2 = UF6
则下列说法正确的是
A.反应①②③都是氧化还原反应
B.反应③中U元素被氧化
C.反应①中氧化剂和还原剂的物质的量之比为2:1
(6)六氟磷酸锂(LiPF6)是锂离子电池广泛使用的电解质。LiPF6与极少量水反应可生成POF3等三种含氟化合物,写出该反应的化学方程式:
您最近一年使用:0次
2020-01-23更新
|
243次组卷
|
4卷引用:福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题
福建省宁德市2019-2020学年高三上学期期末质量检测理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点01-06)(已下线)考点05 元素周期表和元素周期律-2020年高考化学命题预测与模拟试题分类精编河南省郑州市第一中学2021届高三上学期开学测试化学试题
6 . 下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
(1)②表示的元素是_____________ (填元素符号);
(2)①、⑤两种元素的原子半径大小为①________ ⑤(填“< ”或“>”);
(3)③、④两种元素的金属性强弱顺序为:③_________ ④(填“< ”或“>”);
(4)写出⑥最高价氧化物的水化物的化学式_____________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
(1)②表示的元素是
(2)①、⑤两种元素的原子半径大小为①
(3)③、④两种元素的金属性强弱顺序为:③
(4)写出⑥最高价氧化物的水化物的化学式
您最近一年使用:0次
2020-01-21更新
|
231次组卷
|
2卷引用:湖南省茶陵县第三中学2019-2020学年高二上学期期末考试化学(学考)试题
7 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置______ 。 的中子数为
的中子数为________ 。
已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是________ 。
(2)氮和磷氢化物性质的比较:热稳定性:NH3________ PH3(填“>”或“<”)。沸点:N2H4________ P2H4(填“>”或“<”),判断依据是____________ 。
(1)砷在元素周期表中的位置
 的中子数为
的中子数为已知:P(s,白磷)=P(s,黑磷) ΔH=-39.3 kJ·mol-1;P(s,白磷)=P(s,红磷) ΔH=-17.6 kJ·mol-1;由此推知,其中最稳定的磷单质是
(2)氮和磷氢化物性质的比较:热稳定性:NH3
您最近一年使用:0次
2020-01-17更新
|
121次组卷
|
3卷引用:云南省盈江县第一高级中学2019-2020学年高一上学期期末考试化学试题
8 . 下表列出了①~⑪111种元素在元素周期表中的位置:
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩⑪的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因_______________________
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
| 一 | ① | ||||||||||
| 二 | ② | ③ | ④ | ⑤ | |||||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
| 四 | ⑪ | ||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式
(2)画这11种元素中,非金属性最强的元素的原子结构示意图
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)
(4)元素⑨⑩⑪的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素⑪强的原因
您最近一年使用:0次
2020-01-16更新
|
166次组卷
|
2卷引用:北京市顺义区2019~2020学年高一上学期期末考试化学试题
9 . 为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__ 。
(2)下列有关性质的比较,能用元素周期律解释的是__ 。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__ ,用一个离子方程式证明__ 。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①Y的元素符号为__ 。②X的氢化物的电子式__ 。
(1)N在周期表中的位置是
(2)下列有关性质的比较,能用元素周期律解释的是
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①Y的元素符号为
您最近一年使用:0次
10 . 氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________ 。
(2) Po的中子数为
Po的中子数为________ 。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g) H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g) H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________ 。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________ 。
(1)硒在元素周期表中的位置
(2)
 Po的中子数为
Po的中子数为(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)
 H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/molSe(g)+H2(g)
 H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol①硫和硒氢化物的热稳定性:H2S
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式
您最近一年使用:0次



