名校
1 . 元素周期表是学习化学的重要工具。回答下列问题:
(1)硅元素原子核外有______ 种能量不同的电子,有______ 种运动状态不同的电子,写出其最外层电子的电子排布式__________________ 。
(2) 的空间构型和
的空间构型和 相同,写出
相同,写出 的电子式:
的电子式:__________________ 。
(3)部分短周期元素化合价与原子序数的关系可用图示表示。

①元素X在元素周期表中的位置是__________________ 。
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:______________________________ 。
③第三周期主族元素中非金属性最强的两种元素是____________ 和____________ (填元素符号),用一个化学方程式说明这两种元素非金属性的相对强弱:______________________________ 。
(4)第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是____________ ;氧化性最强的阳离子是____________ 。
(5)写出两种W的含氧酸的化学式____________ 、____________ ,设计一种实验方案比较两种酸的酸性强弱,写出反应的化学方程式:________________________ 。
(1)硅元素原子核外有
(2)
 的空间构型和
的空间构型和 相同,写出
相同,写出 的电子式:
的电子式:(3)部分短周期元素化合价与原子序数的关系可用图示表示。

①元素X在元素周期表中的位置是
②写出元素Y和Z的最高价氧化物对应水化物反应的离子方程式:
③第三周期主族元素中非金属性最强的两种元素是
(4)第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是
(5)写出两种W的含氧酸的化学式
您最近一年使用:0次
2 . 下表是元素周期表的一部分,针对表中的①~⑨ 9种元素,回答以下问题:
(1)③与⑥形成的化合物的晶体类型_____________ 。
(2)比较⑥⑦两种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序(用化学式表示):_ 。写出①③⑦形成化合物(其中⑦显+1价)的结构式____________ 。
(3)①元素的阴离子半径___________ ②元素的阳离子半径(填“>”、“<”或“=”)。
(4)用化学反应事实说明⑦与⑨的单质的化学性质活泼性强弱_______ (用离子方程式表示)。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ① | |||||||
二 | ② | ③ | ||||||
三 | ④ | ⑤ | ⑥ | ⑦ | ||||
四 | ⑧ | ⑨ |
(1)③与⑥形成的化合物的晶体类型
(2)比较⑥⑦两种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序(用化学式表示):
(3)①元素的阴离子半径
(4)用化学反应事实说明⑦与⑨的单质的化学性质活泼性强弱
您最近一年使用:0次
名校
3 . 结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______ 。
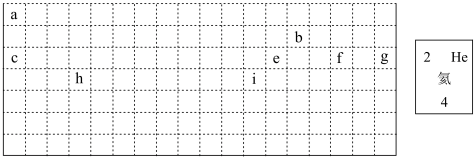
(2)表中所列元素,属于短周期元素的有______ (用元素符号回答),属于主族元素的有______ (用元素符号回答)。
(3)g元素位于第______ 周期第______ 族;i元素位于第______ 周期第______ 族。
(4)元素f是第______ 周期第______ 族元素,请按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量_________ 。
(5)写出b元素的基态原子的电子排布式______ ,写出h元素的符号______ ,该原子的价层电子排布图______ 。
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界

(2)表中所列元素,属于短周期元素的有
(3)g元素位于第
(4)元素f是第
(5)写出b元素的基态原子的电子排布式
您最近一年使用:0次
2019-08-13更新
|
383次组卷
|
2卷引用:新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题
4 . 下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
(1)在这些元素中,⑩最高价氧化物的水化物为__________ 。
(2)写出①的最高价氧化物和②的单质的电子式_________ ,________ 。
(3)用电子式表示③与④形成化合物的过程______________________ 。
(4)①的单质和⑥的氧化物反应的化学方程式______________________ 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:________________________ 写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:_____________________ 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出_________ kJ的热量。
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
(1)在这些元素中,⑩最高价氧化物的水化物为
(2)写出①的最高价氧化物和②的单质的电子式
(3)用电子式表示③与④形成化合物的过程
(4)①的单质和⑥的氧化物反应的化学方程式
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出
您最近一年使用:0次
名校
5 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
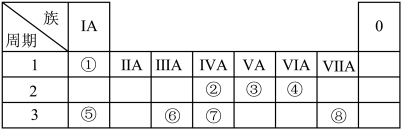
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________ 。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________ 。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________ 。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________ 。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
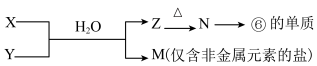
X溶液与Y溶液反应的离子方程式为___________________________________

(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)
(2)⑤、⑧元素的化合物的用电子式表示形成过程:
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
您最近一年使用:0次
6 . 按要求完成下列填空
(1)某原子的激发态原子的电子排布式为1s22s22p63s23p34s1,则该原子基态原子的电子排布式为______________________ ;元素符号为_________ ;其最高价氧化物对应的水化物的化学式是__________ 。
(2)某原子的电子排布式为 [Ne]3s23p1,则该原子的元素符号为______ ,最高正价为______ ,该原子位于元素周期表第_____ 周期第_____ 族,位于元素周期表______ 区。
(3)某原子位于元素周期表第3周期第IA族,则该原子序数为________ ,位于元素周期表______ 区,电子排布式为________________________ 。
(1)某原子的激发态原子的电子排布式为1s22s22p63s23p34s1,则该原子基态原子的电子排布式为
(2)某原子的电子排布式为 [Ne]3s23p1,则该原子的元素符号为
(3)某原子位于元素周期表第3周期第IA族,则该原子序数为
您最近一年使用:0次
2019-08-13更新
|
677次组卷
|
4卷引用:新疆疏勒八一中2018-2019学年高二4月月考化学试题
新疆疏勒八一中2018-2019学年高二4月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
7 . 标号为①~⑩的元素,在元素周期表中的位置如下:
试回答下列问题:
(1)(填写元素符号)①_____ ③______ ⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式为________ ,用电子式表示其形成过程为__________ 。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:______ ﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________ ,在该化合物中既含有________ 键,又含有________ 键。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)①
(2)①和④号元素形成的化合物的化学式为
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是:
(4)①、⑤、⑦号元素形成的一种化合物的电子式是
您最近一年使用:0次
2019-08-09更新
|
584次组卷
|
4卷引用:云南省峨山彝族自治县第一中学2018-2019学年高一下学期期中考试化学试题
8 . 2019年是门捷列夫提出元素周期表150周年,根据元素周期表和周期律,回答问题。
Ⅰ.下表显示了元素周期表中短周期的一部分,①〜⑥代表6种短周期元素。其中②与氢元素形成的简单氢化物分子中含10个电子,能够使湿润的红色石蕊试纸变蓝。
(1)①在周期表中所处的位置为__________ 。
(2)与②同族的第四周期元素的原子结构示意图为__________ 。
(3)写出③与⑥的简单氢化物中沸点较高的分子的电子式__________ 。
(4)④的单质与水反应的离子方程式为__________ 。
(5)工业制取⑤的单质的化学方程式为__________ 。
Ⅱ.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。
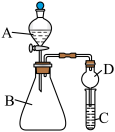
(6)干燥管D的作用是__________ 。
(7)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液观察到C中溶液变蓝,则C试管中发生反应的离子方程式为__________ 。
(8)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液__________ 的现象,该实验设计的原理是利用最高价氧化物对应水化物的酸性强弱来比较元素非金属性的强弱。
Ⅲ.到目前为止,元素周期表的第七周期已经被填满。
(9)请你设想一下,如果发现120号元素,下列有关它在周期表的位置或性质的说法错误的两项是__________ 。
①在第八周期ⅡA族;②最外层电子数是2;③比钙的熔点高;④与水反应放出氢气但比钙缓慢;⑤该元素单质需隔绝空气密封保存;⑥该元素的氧化物属于离子化合物
Ⅰ.下表显示了元素周期表中短周期的一部分,①〜⑥代表6种短周期元素。其中②与氢元素形成的简单氢化物分子中含10个电子,能够使湿润的红色石蕊试纸变蓝。
① | ② | ③ | ||||
④ | ⑤ | ⑥ |
(2)与②同族的第四周期元素的原子结构示意图为
(3)写出③与⑥的简单氢化物中沸点较高的分子的电子式
(4)④的单质与水反应的离子方程式为
(5)工业制取⑤的单质的化学方程式为
Ⅱ.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。

(6)干燥管D的作用是
(7)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液观察到C中溶液变蓝,则C试管中发生反应的离子方程式为
(8)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液
Ⅲ.到目前为止,元素周期表的第七周期已经被填满。
(9)请你设想一下,如果发现120号元素,下列有关它在周期表的位置或性质的说法错误的两项是
①在第八周期ⅡA族;②最外层电子数是2;③比钙的熔点高;④与水反应放出氢气但比钙缓慢;⑤该元素单质需隔绝空气密封保存;⑥该元素的氧化物属于离子化合物
您最近一年使用:0次
2019-08-04更新
|
197次组卷
|
2卷引用:山东省聊城市莘县第一中学2018-2019学年高一下学期期末考试化学试题
解题方法
9 . 下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
(1)在元素①~⑨,最活泼的金属元素是______ (填元素名称);最活泼的非金属元素名称是______ (填元素名称)
(2)用电子式表示元素③与⑤形成的原子个数比为1∶2的化合物______ 。元素①和③所形成的化学键的类型是_______ 。
(3)②、⑤、⑦三种元素的原子半径由大到小的顺序是______ (用元素符号表示)。
(4)元素④和⑨所能形成的气态氢化物的稳定性______ (用化学式表示);元素⑦、⑧、⑨的最高价氧化物对应的水化物的酸性由强到弱的顺序______ (用化学式表示);
(5)写出元素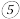 和
和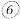 的最高价氧化物的水化物相互反应的离子方程式:
的最高价氧化物的水化物相互反应的离子方程式:______ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅥA | ⅤA | ⅥA | ⅧA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)用电子式表示元素③与⑤形成的原子个数比为1∶2的化合物
(3)②、⑤、⑦三种元素的原子半径由大到小的顺序是
(4)元素④和⑨所能形成的气态氢化物的稳定性
(5)写出元素
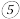 和
和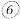 的最高价氧化物的水化物相互反应的离子方程式:
的最高价氧化物的水化物相互反应的离子方程式:
您最近一年使用:0次
10 . 下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
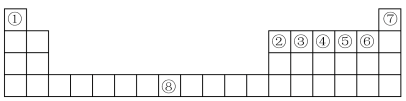
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑦元素位于周期表的__________ 区。
(2)②、⑥两元素形成的化合物的空间构型为__________ ,其中心原子的杂化轨道类型为__________ 。
(3)写出元素⑧基态原子的电子排布式_______________________ 。
(4)③④⑤⑥四种元素第一电离能的由小到大的顺序为______________ (填元素符号)。
(5)与③⑤形成的三原子化合物互为等电子体的分子为__________________ 。
(6)元素⑧与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为−20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于__________ 晶体(填晶体类型)。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑦元素位于周期表的
(2)②、⑥两元素形成的化合物的空间构型为
(3)写出元素⑧基态原子的电子排布式
(4)③④⑤⑥四种元素第一电离能的由小到大的顺序为
(5)与③⑤形成的三原子化合物互为等电子体的分子为
(6)元素⑧与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为−20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次



