1 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式是S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______ ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______ ;
(3)Se的核外M层电子的排布式为_______ ;
(4)H2Se的酸性比 H2S_______ (填“强”或“弱”)。
(5)H2SeO3的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:_______ ;
②H2SeO4比H2SeO3酸性强的原因:_______ 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示, 其晶胞边长为540.0pm,密度为_______ g • cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_______ pm(列式表示)

(1)S单质的常见形式是S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的核外M层电子的排布式为
(4)H2Se的酸性比 H2S
(5)H2SeO3的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示, 其晶胞边长为540.0pm,密度为

您最近一年使用:0次
2022·浙江·模拟预测
解题方法
2 . 铜、钛、硼及其化合物有许多用途。回答下列问题:
(1)S、O、N三种元素的第一电离能由大到小的顺序为___________ , 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2) 的熔点是
的熔点是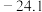 ℃,沸点是136.4℃,则固态
℃,沸点是136.4℃,则固态 属于
属于___________ 晶体。
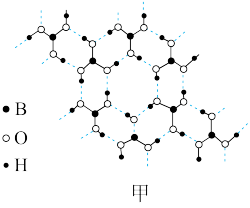
(3)基态硼原子的核外电子排布图为___________ ,硼酸的层状结构如图甲,其中B的杂化类型是___________ 。
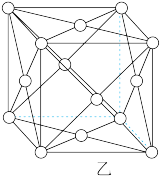
(4)铜的晶胞结构如图乙,铜原子的配位数为___________ ,若铜原子的半径为apm,则铜晶体的密度为___________  (写表达式即可)。
(写表达式即可)。
(1)S、O、N三种元素的第一电离能由大到小的顺序为
 中阴离子的空间构型为
中阴离子的空间构型为(2)
 的熔点是
的熔点是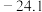 ℃,沸点是136.4℃,则固态
℃,沸点是136.4℃,则固态 属于
属于(3)基态硼原子的核外电子排布图为

(4)铜的晶胞结构如图乙,铜原子的配位数为
 (写表达式即可)。
(写表达式即可)。
您最近一年使用:0次
3 . 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_______ , 位于元素周期表的
位于元素周期表的_______ 区,基态N原子的价电子排布图为_______ 。
(2)金属Cu晶体采取的是以下_______ (填序号)面心立方最密堆积方式。

(3) 元素可形成
元素可形成 ,其中存在的化学键类型有(填序号)
,其中存在的化学键类型有(填序号)_______ ;
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)在硫酸铜溶液中逐滴滴加氨水至过量,实验现象为先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液,写出此蓝色沉淀溶解的离子方程式:_______ 。 中
中 键的数目为
键的数目为_______ 。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:

①若坐标参数A为(0,0,0),B为(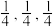 ),则C的坐标参数为
),则C的坐标参数为_______ ;
②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为_______ g•cm-3
(6)CuO在高温下易转化为Cu2O,其原因是_______ 。
(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为 位于元素周期表的
位于元素周期表的(2)金属Cu晶体采取的是以下

(3)
 元素可形成
元素可形成 ,其中存在的化学键类型有(填序号)
,其中存在的化学键类型有(填序号)①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)在硫酸铜溶液中逐滴滴加氨水至过量,实验现象为先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液,写出此蓝色沉淀溶解的离子方程式:
 中
中 键的数目为
键的数目为(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:

①若坐标参数A为(0,0,0),B为(
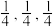 ),则C的坐标参数为
),则C的坐标参数为②若阿伏加德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为
(6)CuO在高温下易转化为Cu2O,其原因是
您最近一年使用:0次
解题方法
4 . Fe、Ni均为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)基态Fe原子的原子结构示意图为______ ,依据电子排布特点,铁属于元素周期表中______ 区元素。
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为______ 。
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是_____ 。
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图,Fe2+的配位数为_____ 。

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=______ (填写计算表达式)。
(1)基态Fe原子的原子结构示意图为
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO
②FeO晶胞如图,Fe2+的配位数为

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=
您最近一年使用:0次
5 . 碳族元素中的碳、硅、锗、铅及其化合物在诸多领域有重要用途。下列说法正确的是
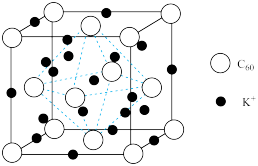

| A.一种超导体晶胞如图所示,1个晶胞中含有240个C原子 |
| B.硅是重要的半导体材料,可制成二极管、三极管和光导纤维 |
C.基态锗(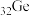 )原子外围电子排布式为 )原子外围电子排布式为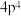 |
D.铅蓄电池放电时的负极反应为: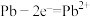 |
您最近一年使用:0次
解题方法
6 . 镍及其化合物在工业生产和科研领域有着重要的用途。回答下列问题:
(1)基态 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为___________ 。
(2)醋酸镍晶体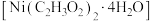 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为___________ ,若该晶胞构型为四方双锥,则中心 原子的配位数为
原子的配位数为___________ 。
(3)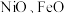 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: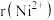
___________ (填“<”或“>”)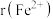 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为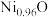 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与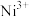 的数目之比为
的数目之比为___________ 。
(4)四羰基镍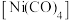 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是___________ ; 分子内
分子内 键与
键与 键个数之比为
键个数之比为___________ 。
(5)金属镍与镧( )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。

(1)基态
 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为(2)醋酸镍晶体
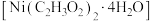 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为 原子的配位数为
原子的配位数为(3)
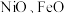 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: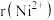
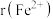 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为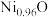 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与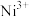 的数目之比为
的数目之比为(4)四羰基镍
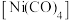 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是 分子内
分子内 键与
键与 键个数之比为
键个数之比为(5)金属镍与镧(
 )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
7 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)铜副族位于周期表_______ 区,基态Cu原子的价电子排布式为 _______ 。
(2)向 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为_______ 。继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式_______ 。 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
(3) 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ , 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为_______ 。

(1)铜副族位于周期表
(2)向
 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为 的空间构型为
的空间构型为(3)
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为

您最近一年使用:0次
解题方法
8 . 第VIII族元素(Fe、Co、Ni等)在生产、生活中用途广泛。回答下列问题:
(1)第四周期基态原子与基态Ni3+未成对电子数相同的元素有_______ 种。
(2)邻二氮菲(phen,结构如图)能通过N原子与Fe2+形成稳定的配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。[Fe(phen)3]2+中Fe2+的配位数为_______ ;实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,其原因是_______ 。

(3)草酸亚铁是生产磷酸铁锂动力电池的原料,可由草酸与硫酸亚铁铵反应制得。草酸与甲酸酸性相对强弱:草酸_______ 甲酸(填“>”“<”或“=”),其原因是_______ 。
(4)Fe3O4晶胞具有反尖晶石结构,氧离子和不同价态铁离子构成A、B两种结构,如图所示,其晶胞可以看作是由4个A型和4个B型小单元交替并置而成。

①Fe3+填充在O2-围成的_______ 空隙处(填“正四面体”或“正八面体”)。
②纳米材料的量子尺寸效应可以显著改变材料电磁性能,材料表面原子(或离子)占总原子(或离子)数的比例是重要的影响因素。假设某Fe3O4纳米颗粒恰好是一个Fe3O4晶胞,该颗粒表面离子与总离子数的最简整数比为_______ 。
(1)第四周期基态原子与基态Ni3+未成对电子数相同的元素有
(2)邻二氮菲(phen,结构如图)能通过N原子与Fe2+形成稳定的配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。[Fe(phen)3]2+中Fe2+的配位数为

(3)草酸亚铁是生产磷酸铁锂动力电池的原料,可由草酸与硫酸亚铁铵反应制得。草酸与甲酸酸性相对强弱:草酸
(4)Fe3O4晶胞具有反尖晶石结构,氧离子和不同价态铁离子构成A、B两种结构,如图所示,其晶胞可以看作是由4个A型和4个B型小单元交替并置而成。

①Fe3+填充在O2-围成的
②纳米材料的量子尺寸效应可以显著改变材料电磁性能,材料表面原子(或离子)占总原子(或离子)数的比例是重要的影响因素。假设某Fe3O4纳米颗粒恰好是一个Fe3O4晶胞,该颗粒表面离子与总离子数的最简整数比为
您最近一年使用:0次
9 . 金刚石硬度大,熔点高,用途非常广泛。工业上利用反应 人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的
人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的 与
与 的距离为
的距离为 。设
。设 为阿伏加德罗常数的值,下列有关说法错误的是
为阿伏加德罗常数的值,下列有关说法错误的是
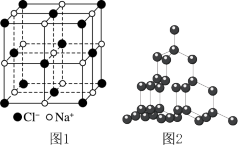
 人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的
人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的 与
与 的距离为
的距离为 。设
。设 为阿伏加德罗常数的值,下列有关说法错误的是
为阿伏加德罗常数的值,下列有关说法错误的是
A. 、 、 均属于元素周期表中的 均属于元素周期表中的 区元素 区元素 |
B. 、 、 、金刚石晶体类型不同 、金刚石晶体类型不同 |
C.若 晶体密度为 晶体密度为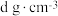 ,则 ,则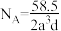 |
D. 金刚石(晶体结构如图2所示)中含有 金刚石(晶体结构如图2所示)中含有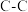 键的数目为 键的数目为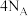 |
您最近一年使用:0次
2022-07-08更新
|
332次组卷
|
2卷引用:湖南省三湘名校教育联盟、五市十校教研教改共同体2021-2022学年高二下学期期末考试化学试题
名校
10 . 某物质用途非常广泛,可用来制造耐火陶瓷,作颜料,还可以用于冶炼金属。其具有的长方体形晶胞结构可用下图表示,已知6个N原子形成了正八面体,晶胞参数的单位为pm,M原子的相对原子质量为m,N原子的相对原子质量为n。下列说法错误的是
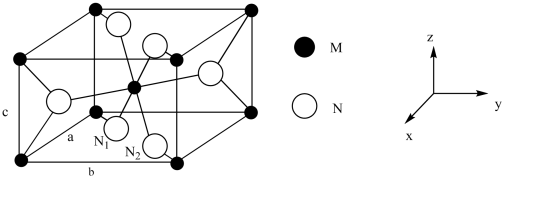

A.该物质的化学式可能为 |
B.该晶胞密度为 |
| C.M原子的配位数为6,N原子的配位数为3 |
D.若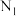 原子的坐标为(x,x,0),则 原子的坐标为(x,x,0),则 原子的分数坐标为(1-x,1-x,0) 原子的分数坐标为(1-x,1-x,0) |
您最近一年使用:0次



