解题方法
1 . 铜及其化合物在科学研究和工业生产中具有广泛用途。请回答下列问题:
(1)铜的熔点比钙的高,其原因是_______ 。
(2)Cu可能形成金属互化物,金属互化物的结构类型丰富多样。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是通过_______ 测定。
(3)配合物CuSO4·5H2O结构示意图如下:

CuSO4·5H2O中不存在的相互作用有_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)将CuSO4·5H2O溶于水得蓝色溶液,加入氨水后形成难溶物。继续加入氨水,难溶物溶解,得到深蓝色的透明溶液,再加入乙醇后有深蓝色晶体析出。上述实验可证明H2O的配位能力_______ NH3(填“大于”“小于”或“等于”),难溶物溶解的离子方程式为_______ 。
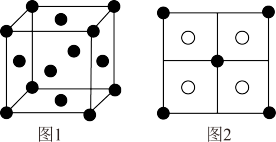
(5)常见的铜的硫化物有CuS和Cu2S两种,它们的晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体空隙中心,两晶胞的侧视图相同如图2所示。CuS晶胞中,有_______ %(填具体数字)的四面体空隙填充了铜离子;若Cu2S的晶胞参数为a pm, 阿伏加德罗常数的值为NA,则Cu2S晶胞的密度为_______ g·cm-3。
(1)铜的熔点比钙的高,其原因是
(2)Cu可能形成金属互化物,金属互化物的结构类型丰富多样。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是通过
(3)配合物CuSO4·5H2O结构示意图如下:

CuSO4·5H2O中不存在的相互作用有
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)将CuSO4·5H2O溶于水得蓝色溶液,加入氨水后形成难溶物。继续加入氨水,难溶物溶解,得到深蓝色的透明溶液,再加入乙醇后有深蓝色晶体析出。上述实验可证明H2O的配位能力
(5)常见的铜的硫化物有CuS和Cu2S两种,它们的晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体空隙中心,两晶胞的侧视图相同如图2所示。CuS晶胞中,有

您最近一年使用:0次
2022-04-22更新
|
175次组卷
|
2卷引用:湖北省武汉市部分重点中学2021-2022学年高二下学期期中联考化学试题
解题方法
2 . 氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。我国科研工作者受此启迪,发现 (俗称砒霜)对白血病有明显的治疗作用。
(俗称砒霜)对白血病有明显的治疗作用。
(1)基态砷原子的价电子排布图为_______ 。
(2)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 ,其中
,其中 中
中 的杂化方式为
的杂化方式为_______ , 的空间构型为
的空间构型为_______ , 中含有的化学键类型包括
中含有的化学键类型包括_______ 。
(3) 中
中 的键角比NH3中
的键角比NH3中 的键角大的原因是
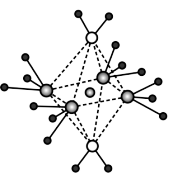
的键角大的原因是_______ ;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图),该化合物加热时首先失去水的原因是_______ (请从原子结构角度加以分析)。
(4)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有_______ (填序号)。
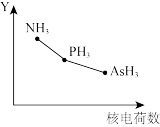
①稳定性 ②R-H键之间的键角 ③分子间作用力 ④还原性
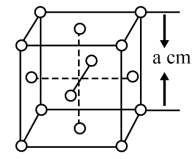
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_______  (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
 (俗称砒霜)对白血病有明显的治疗作用。
(俗称砒霜)对白血病有明显的治疗作用。(1)基态砷原子的价电子排布图为
(2)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 ,其中
,其中 中
中 的杂化方式为
的杂化方式为 的空间构型为
的空间构型为 中含有的化学键类型包括
中含有的化学键类型包括(3)
 中
中 的键角比NH3中
的键角比NH3中 的键角大的原因是
的键角大的原因是
(4)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有

①稳定性 ②R-H键之间的键角 ③分子间作用力 ④还原性
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NA,则该晶体的密度为
 (用含NA、a的式子表示)。
(用含NA、a的式子表示)。
您最近一年使用:0次
解题方法
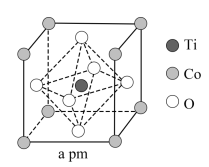
3 . 钴及其配合物在生活、生产中用途广泛。请回答下列问题:
(1)[Co(NH3)5Cl]Cl2是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为____ 价,中心原子的配体为____ 。0.1mol[Co(NH3)5Cl]Cl2中含有的配位键数目为____ ,当向其中加入足量硝酸银溶液时,生成的AgCl质量为____ g。
(2)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为____ ,该配合物涉及的非金属元素的第一电离能由大到小的顺序是____ (填元素符号)。

(3)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为____ ,设阿伏加德罗常数的值为NA,晶胞的底面积为a(nm)2,晶胞的密度为ρg·cm-3,则该晶胞的高c为____ nm。

(1)[Co(NH3)5Cl]Cl2是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为
(2)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为

(3)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为

您最近一年使用:0次
名校
解题方法
4 . 磷元素的化合物在科学研究和工业生产中有许多重要用途。回答下列问题:
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
(2)白磷在空气中缓慢氧化生成P4O6,P4O6的结构如图1所示。P4O6中氧原子的杂化轨道类型为_______ ,每个P4O6分子中含孤电子对的数目为_______ 。
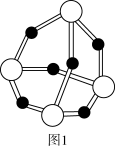
(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为_______ ,磷原子的配位数为_______ 。
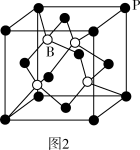
(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为_______ 。
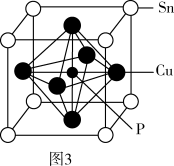
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的_______ 的空隙中。若晶体密度为ag·cm-3,P原子与最近的Cu原子的核间距为_______ nm(用含NA的代数式表示,NA为阿伏加德罗常数的值)。
(1)下列状态的P中,电离最外层一个电子所需能量最小的是_______(填标号)。
A. | B.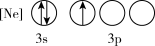 |
C.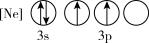 | D.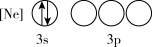 |

(3)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图2所示。在一个晶胞中磷原子空间堆积方式为

(4)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(5)磷青铜晶体的晶胞结构如图3所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
5 . 铁、钴及其化合物在生活、生产中用途广泛。请回答下列问题:
(1)基态 的核外电子排布式为
的核外电子排布式为_______ ;第四周期元素中,基态原子未成对电子数与Co相等的有_______ (填元素符号)。
(2) 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有_______ 种,其中极性分子有_______ 种;取 ,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为
,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为_______ 。
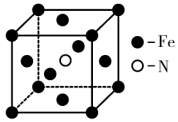
(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为_______ 。
(4)钴蓝晶体的立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其结构如下图,晶体中 占据
占据 形成的
形成的_______ (填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为_______ g/cm3(列计算式)。

(1)基态
 的核外电子排布式为
的核外电子排布式为(2)
 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有 ,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为
,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为

(4)钴蓝晶体的立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其结构如下图,晶体中
 占据
占据 形成的
形成的
您最近一年使用:0次
6 . 第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。试回答下列问题:
(1)按照电子排布,可把元素周期表中的元素划分成五个区,VIII族元素位于周期表中_______ 区;写出基态Co原子的价层电子排布式_______ ;Co3+的半径_______ Fe2+的半径(填“大 于”或“小于”),第四电离能I4(Co)<I4(Fe)的原因是_______ 。
(2)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的主族元素名称_______ 。Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ 。确定Ni(CO)4固体为晶体的最可靠方法是_______ 。某同学画出基态碳原子的核外电子排布图: ,该电子排布图违背了
,该电子排布图违背了_______ 。
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是_______ ;已知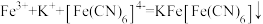 ,利用该离子方程式可以检验溶液中的Fe3+。
,利用该离子方程式可以检验溶液中的Fe3+。 中σ键、π键数目之比为
中σ键、π键数目之比为_______ 。
(4)某立方晶系的(Sb-Ni)合金用途广泛,下图为该合金的晶胞结构图:

①Ni和Sb原子数之比为_______ ;
②与Sb最邻近的Sb原子数为_______ 个。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,VIII族元素位于周期表中
(2)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的主族元素名称
 ,该电子排布图违背了
,该电子排布图违背了(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是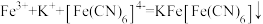 ,利用该离子方程式可以检验溶液中的Fe3+。
,利用该离子方程式可以检验溶液中的Fe3+。 中σ键、π键数目之比为
中σ键、π键数目之比为(4)某立方晶系的(Sb-Ni)合金用途广泛,下图为该合金的晶胞结构图:

①Ni和Sb原子数之比为
②与Sb最邻近的Sb原子数为
您最近一年使用:0次
7 . 硼、镓、氮的化合物在生产、生活中有广泛用途:
(1)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价电子排布图为____ ;基态N原子的核外有___ 种空间运动状态的电子。
Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:
(2)Fe元素位于元素周期表的____ 区(填分区)。
(3)基态Ni3+核外电子排布式为____ 。
(4)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如图1所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___ (填元素符号),其中C原子的杂化类型为___ 。
②图中各微粒间不存在的作用力有___ (填标号)。
a.配位键b.极性键c.非极性键d.π键e.离子键f.氢键
(5)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图2所示。

该铁氮化合物的化学式为____ 。
(1)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价电子排布图为
Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:
(2)Fe元素位于元素周期表的
(3)基态Ni3+核外电子排布式为
(4)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如图1所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a.配位键b.极性键c.非极性键d.π键e.离子键f.氢键
(5)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图2所示。

该铁氮化合物的化学式为
您最近一年使用:0次
解题方法
8 . 回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:
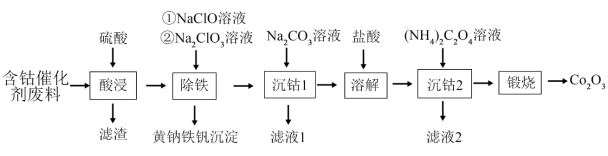
已知:i.金属钴与铁具有相似的化学性质;
ii.氧化性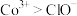 。
。
回答下列问题:
(1)酸浸后,“滤渣”的主要成分有_______ 和_______ (填化学式)。
(2)基态钴原子的价电子排布式为_______ 。
(3)已知CoO的熔点(1785℃)高于FeO的熔点(1369℃),其原因是_______ 。
(4)“除铁”时加入NaClO,主要反应的离子方程式为_______ ,再加入 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
(5) 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ 。 中除氢元素外,其他元素电负性由大到小的顺序为
中除氢元素外,其他元素电负性由大到小的顺序为_______ 。
(6)“滤液2”中主要溶质的常见用途为_______ 。
(7)所得 可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为
可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为_______ 个。设 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为_______  (列出计算式)。
(列出计算式)。
 、CaO、
、CaO、 )制备氧化钴(Co2O3)的工艺流程如下图所示:
)制备氧化钴(Co2O3)的工艺流程如下图所示:
已知:i.金属钴与铁具有相似的化学性质;
ii.氧化性
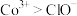 。
。回答下列问题:
(1)酸浸后,“滤渣”的主要成分有
(2)基态钴原子的价电子排布式为
(3)已知CoO的熔点(1785℃)高于FeO的熔点(1369℃),其原因是
(4)“除铁”时加入NaClO,主要反应的离子方程式为
 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。(5)
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 中除氢元素外,其他元素电负性由大到小的顺序为
中除氢元素外,其他元素电负性由大到小的顺序为(6)“滤液2”中主要溶质的常见用途为
(7)所得
 可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为
可用于合成钓酸钴。一种钛酸钴的晶胞结构如图所示,该晶胞中与Co距离最近的O的数目为 为阿伏加德罗常数的值,该钛酸钴晶体的密度为
为阿伏加德罗常数的值,该钛酸钴晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
9 . 第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。请回答下列问题:
(1)第VIII族元素位于周期表中____ 区;Co3+的半径_____ Fe2+的半径(填“>”或“<”)。
(2)Ni与CO在60~80℃时反应生成Ni(CO)4气体,Ni(CO)4为____ 分子(填“极性”或“非极性”)。确定Ni(CO)4固体为晶体的最可靠方法是____ ;硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]SO4中,阴离子的空间结构为____ 。
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显色。二者碳原子的杂化类型为
)均显色。二者碳原子的杂化类型为____ ;邻苯二酚的沸点____ 对苯二酚的沸点(填“>”或“<”)。
(4)超细氧化镍是一种功能材料,用途十分广泛,其晶胞结构如图:
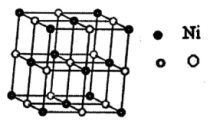
氧化镍的化学式为____ ;设晶胞边长为apm,该物质的密度表达式为____ g•cm-3。
(1)第VIII族元素位于周期表中
(2)Ni与CO在60~80℃时反应生成Ni(CO)4气体,Ni(CO)4为
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显色。二者碳原子的杂化类型为
)均显色。二者碳原子的杂化类型为(4)超细氧化镍是一种功能材料,用途十分广泛,其晶胞结构如图:

氧化镍的化学式为
您最近一年使用:0次
10 . 铬元素在工业中各个领域应用广泛,回答下列问题:
(1)基态铬原子的外围电子排布式为____ 、电子占据的最高能级的轨道形状为____ 。
(2)常温下,氯化酰铬(CrO2Cl2)为暗红色液体,能溶解在常见的有机溶剂中。则氯化酰铬的晶体类型为____ ,CS2是一种常见的能溶解氯化酰铬的有机溶剂,其分子形状为____ 。
(3)氮化铬(CrN)晶体在工业上用途广泛,其晶胞结构如图所示,则该晶胞结构与____ (填一种常见的离子晶体的化学式)的晶胞结构一样;氮化铬晶体的熔点与MgO晶体的熔点的大小关系为____ 。
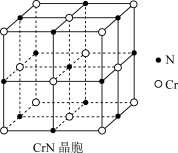
(4)已知氮化铬晶胞的边长为acm,阿伏加德罗常数值为NA,则该晶体的密度为____ (用含a、NA的式子表示)。
(1)基态铬原子的外围电子排布式为
(2)常温下,氯化酰铬(CrO2Cl2)为暗红色液体,能溶解在常见的有机溶剂中。则氯化酰铬的晶体类型为
(3)氮化铬(CrN)晶体在工业上用途广泛,其晶胞结构如图所示,则该晶胞结构与

(4)已知氮化铬晶胞的边长为acm,阿伏加德罗常数值为NA,则该晶体的密度为
您最近一年使用:0次



