1 . 金属锶(Sr)可用于制造合金、光电管和照明灯等。一种从锌冶炼阳极泥(主要成分为 、
、 、
、 和ZnO)中回收金属元素的工艺如下:
和ZnO)中回收金属元素的工艺如下: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
②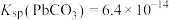 ,
, 。
。
③ 的熔点874℃,其水溶液显弱酸性。
的熔点874℃,其水溶液显弱酸性。
(1)滤液1的主要成分为_______ 。
(2)“还原酸浸”中,反应的离子方程式为_______ 。
(3)“焙烧”时,除生成硫化锶,还生成了一种还原性气体,该反应的化学方程式为_______ 。
(4)从滤液2中获得 晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是
晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ 。
(5)“结晶”得到的是六水合氯化锶晶体,电解前需要转化为无水氯化锶,相应的操作为_______ ,相比传统惰性电极电解熔融氯化锶制备金属锶,本电解工艺优点为_______ 。(任写一条)
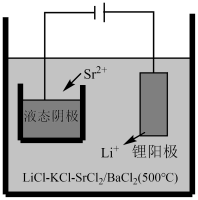
(6)利用锶制备得到的钛酸锶可用于光催化还原 实现“碳中和”,原理如图所示。铂电极的电极反应式为
实现“碳中和”,原理如图所示。铂电极的电极反应式为_______ , 的迁移方向为
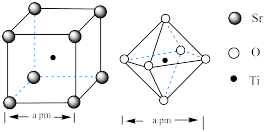
的迁移方向为_______ 。(填“从左到右”或“从右到左”)_______ ,其晶胞中一个O周围和它最近且距离相等的O有_______ 个。
 、
、 、
、 和ZnO)中回收金属元素的工艺如下:
和ZnO)中回收金属元素的工艺如下: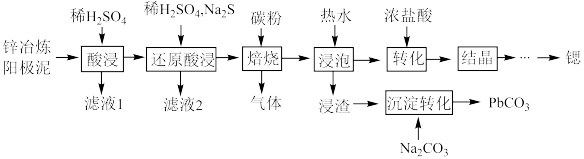
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②
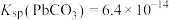 ,
, 。
。③
 的熔点874℃,其水溶液显弱酸性。
的熔点874℃,其水溶液显弱酸性。(1)滤液1的主要成分为
(2)“还原酸浸”中,反应的离子方程式为
(3)“焙烧”时,除生成硫化锶,还生成了一种还原性气体,该反应的化学方程式为
(4)从滤液2中获得
 晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是
晶体的操作包括蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是(5)“结晶”得到的是六水合氯化锶晶体,电解前需要转化为无水氯化锶,相应的操作为
(6)利用锶制备得到的钛酸锶可用于光催化还原
 实现“碳中和”,原理如图所示。铂电极的电极反应式为
实现“碳中和”,原理如图所示。铂电极的电极反应式为 的迁移方向为
的迁移方向为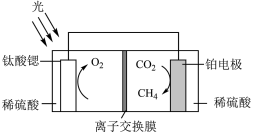
您最近一年使用:0次
2 . 向盛有一定质量 、
、 和
和 混合溶液的烧杯中,逐渐加入锌粉至过量使其充分反应。烧杯里“溶液中溶质的质量”和“金属固体的质量”随锌粉质量变化情况如图所示,下列说法正确的是
混合溶液的烧杯中,逐渐加入锌粉至过量使其充分反应。烧杯里“溶液中溶质的质量”和“金属固体的质量”随锌粉质量变化情况如图所示,下列说法正确的是
 、
、 和
和 混合溶液的烧杯中,逐渐加入锌粉至过量使其充分反应。烧杯里“溶液中溶质的质量”和“金属固体的质量”随锌粉质量变化情况如图所示,下列说法正确的是
混合溶液的烧杯中,逐渐加入锌粉至过量使其充分反应。烧杯里“溶液中溶质的质量”和“金属固体的质量”随锌粉质量变化情况如图所示,下列说法正确的是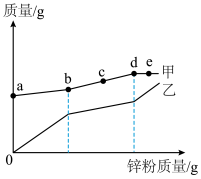
A.甲曲线ab段发生反应: |
| B.乙曲线表示“溶液中溶质的质量”随锌粉质量变化情况 |
| C.反应过程中溶液质量减小 |
D.e点时,溶液中大量存在的金属阳离子是 和 和 |
您最近一年使用:0次
解题方法
3 . 生活中蕴含着丰富的化学知识。下列相关解释错误的是
| A.用过氧乙酸溶液对居住环境消毒:CH3COOOH具有较强氧化性 |
B.做豆腐时用石膏作凝固剂: 是硫酸盐结晶水合物 是硫酸盐结晶水合物 |
| C.制作腌菜、酱菜时添加食盐:高浓度的NaCl溶液使微生物脱水失活 |
| D.果汁中添加维生素C:维生素C作抗氧剂 |
您最近一年使用:0次
4 . 含铬污泥酸浸后的浸出液主要含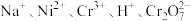 和
和 ,经过如下主要流程,可制得红矾钠
,经过如下主要流程,可制得红矾钠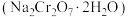 ,实现铬资源的循环利用。
,实现铬资源的循环利用。 范围如下。
范围如下。
(1)基态Cr原子价层电子排布式为_____ , 的空间构型为
的空间构型为_____ 。
(2)①中, 还原
还原 的离子方程式为
的离子方程式为_____ 。
(3)②中,加入 的目的是调节溶液的
的目的是调节溶液的 ,
, 的调节范围是
的调节范围是_____ ,为保证 沉淀完全,则
沉淀完全,则 最低浓度为
最低浓度为_____  。已知
。已知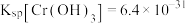 。
。
(4)从 到
到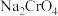 的过程中,在投料比、反应时间均相同时,若温度过高,
的过程中,在投料比、反应时间均相同时,若温度过高,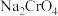 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是_____ 。
(5)对 固体进行热重分析,控制一定温度在空气中加热,充分反应后固体失重率约为18.45%,剩余固体为Cr的氧化物,则其化学式为
固体进行热重分析,控制一定温度在空气中加热,充分反应后固体失重率约为18.45%,剩余固体为Cr的氧化物,则其化学式为_____ 。
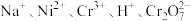 和
和 ,经过如下主要流程,可制得红矾钠
,经过如下主要流程,可制得红矾钠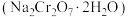 ,实现铬资源的循环利用。
,实现铬资源的循环利用。
 范围如下。
范围如下。| 金属离子 | 开始沉淀的 | 沉淀完全的 |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
(1)基态Cr原子价层电子排布式为
 的空间构型为
的空间构型为(2)①中,
 还原
还原 的离子方程式为
的离子方程式为(3)②中,加入
 的目的是调节溶液的
的目的是调节溶液的 ,
, 的调节范围是
的调节范围是 沉淀完全,则
沉淀完全,则 最低浓度为
最低浓度为 。已知
。已知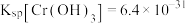 。
。(4)从
 到
到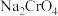 的过程中,在投料比、反应时间均相同时,若温度过高,
的过程中,在投料比、反应时间均相同时,若温度过高,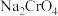 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)对
 固体进行热重分析,控制一定温度在空气中加热,充分反应后固体失重率约为18.45%,剩余固体为Cr的氧化物,则其化学式为
固体进行热重分析,控制一定温度在空气中加热,充分反应后固体失重率约为18.45%,剩余固体为Cr的氧化物,则其化学式为
您最近一年使用:0次
5 . 六安市金寨县关庙沙坪沟的钼矿储量居亚洲第一。四钼酸铵是钼深加工的重要中间产品,具有广泛的用途。现以该钼精矿(主要含 ,还有
,还有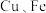 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。
(1)已知基态 的价层电子排布式为
的价层电子排布式为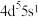 ,则Mo在元素周期表的位置为
,则Mo在元素周期表的位置为___________ 。
(2)“浸出”时, 转化为
转化为 的离子方程式为
的离子方程式为___________ 。“浸出”也可用氨水,此时钼元素转化为 ,铜元素转化为
,铜元素转化为 (深蓝色)。已知:
(深蓝色)。已知: 为蓝色。用
为蓝色。用 沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:
沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:___________ 。
(3)“净化”时,浸出液中残留的 转化为沉淀除去。如何检验
转化为沉淀除去。如何检验 是否除尽?
是否除尽?___________ 。
(4)矿物共存是一种常见现象,该钼精矿还有少量钨元素,可采用溶剂萃取法除去。将“浸出”后的钼酸盐硫化后用季胺盐萃取剂萃取,它对硫代钼酸根的亲和力远高于 ,因此可优先萃取出钼,其反应为:
,因此可优先萃取出钼,其反应为: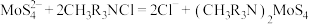 。再采用反萃取剂在碱性条件下制得
。再采用反萃取剂在碱性条件下制得 ,该反萃取剂可选用___________。
,该反萃取剂可选用___________。
(5)钼酸铅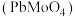 难溶于水,其
难溶于水,其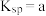 ,常用作钼的质量测定,在
,常用作钼的质量测定,在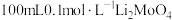 溶液中,加入
溶液中,加入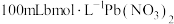 溶液,使
溶液,使 恰好沉淀完全,即
恰好沉淀完全,即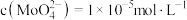 ,则
,则
___________ (忽略混合时溶液体积的变化)。
(6)钼精矿冶金工艺也可以采用电氧化法,其工作原理如图所示:___________ 。
②若维持电流强度恒定,电源提供电子的速率为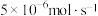 ,则消耗
,则消耗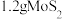 ,理论上需要电解
,理论上需要电解___________ min。
 ,还有
,还有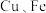 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。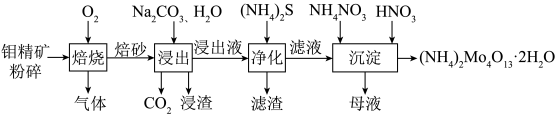
(1)已知基态
 的价层电子排布式为
的价层电子排布式为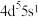 ,则Mo在元素周期表的位置为
,则Mo在元素周期表的位置为(2)“浸出”时,
 转化为
转化为 的离子方程式为
的离子方程式为 ,铜元素转化为
,铜元素转化为 (深蓝色)。已知:
(深蓝色)。已知: 为蓝色。用
为蓝色。用 沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:
沉钼时,溶液由深蓝色变为蓝色,从平衡移动角度说明其原因:(3)“净化”时,浸出液中残留的
 转化为沉淀除去。如何检验
转化为沉淀除去。如何检验 是否除尽?
是否除尽?(4)矿物共存是一种常见现象,该钼精矿还有少量钨元素,可采用溶剂萃取法除去。将“浸出”后的钼酸盐硫化后用季胺盐萃取剂萃取,它对硫代钼酸根的亲和力远高于
 ,因此可优先萃取出钼,其反应为:
,因此可优先萃取出钼,其反应为: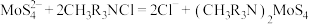 。再采用反萃取剂在碱性条件下制得
。再采用反萃取剂在碱性条件下制得 ,该反萃取剂可选用___________。
,该反萃取剂可选用___________。A. | B. | C. | D. |
(5)钼酸铅
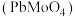 难溶于水,其
难溶于水,其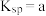 ,常用作钼的质量测定,在
,常用作钼的质量测定,在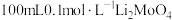 溶液中,加入
溶液中,加入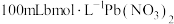 溶液,使
溶液,使 恰好沉淀完全,即
恰好沉淀完全,即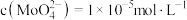 ,则
,则
(6)钼精矿冶金工艺也可以采用电氧化法,其工作原理如图所示:
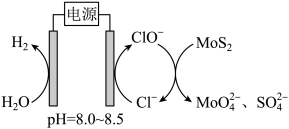
②若维持电流强度恒定,电源提供电子的速率为
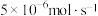 ,则消耗
,则消耗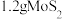 ,理论上需要电解
,理论上需要电解
您最近一年使用:0次
解题方法
6 . 某实验小组设计了以下实验探究AgNO3与KI之间的反应。
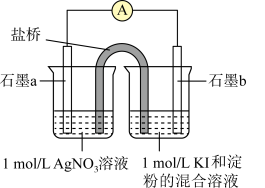
(1)成员甲向盛有4mL 1mol/L AgNO3溶液(pH≈5.5)的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。对应的离子方程式为___________ ;已知:25℃时,Ksp(AgI)=8.5×10−17,求反应后,溶液中c(I−)=___________ mol/L(保留2位有效数字)
(2)成员乙提出Ag+具有一定氧化性,I−具有一定的还原性,二者可能发生氧化还原反应。于是设计了如图所示的装置。实验开始后,电流表指针发生偏转且示数为A1,右侧溶液转为蓝色。___________ (填“氧化”或“还原”)反应;
②a极上的电极反应式是___________ 。
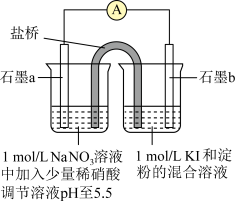
(3)成员丙对成员乙的实验产生质疑,认为仅凭电流表偏转无法严谨说明,成员丙对乙实验产生质疑的原因是___________ 。他又做了一组对比实验(如图所示),电流表指针发生偏转示数为A2(A2≈0.1A1)。由实验现象可知,成员乙的推断___________ (填“是”或“不”)合理。___________ (填“小”或“大”)。
(1)成员甲向盛有4mL 1mol/L AgNO3溶液(pH≈5.5)的试管中加入1mL1mol/LKI溶液,振荡后,试管中出现黄色沉淀,向其中加入淀粉溶液,无明显变化。对应的离子方程式为
(2)成员乙提出Ag+具有一定氧化性,I−具有一定的还原性,二者可能发生氧化还原反应。于是设计了如图所示的装置。实验开始后,电流表指针发生偏转且示数为A1,右侧溶液转为蓝色。
②a极上的电极反应式是
(3)成员丙对成员乙的实验产生质疑,认为仅凭电流表偏转无法严谨说明,成员丙对乙实验产生质疑的原因是
您最近一年使用:0次
7 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
(1)若含硫矿物为黄铁矿( ),则途径Ⅰ煅烧得到的还原产物为
),则途径Ⅰ煅烧得到的还原产物为___________ 。
(2)途径Ⅱ的反应为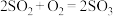 ,该反应在
,该反应在 催化作用下,反应分两步完成。已知第一步反应为:
催化作用下,反应分两步完成。已知第一步反应为: ;写出第二步反应化学方程式
;写出第二步反应化学方程式___________ 。
(3)下列有关说法不正确 的是___________。
(4)若白色沉淀为 ,则X可能是
,则X可能是___________ (写出一种物质化学式即可,下同)若白色沉淀为 ,则X可能是
,则X可能是___________ 。
(5)已知A与水作用能得到 和另一种强酸,则物质A的化学式为
和另一种强酸,则物质A的化学式为___________ ,请设计实验证明A的水溶液中另一种强酸的阴离子___________ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。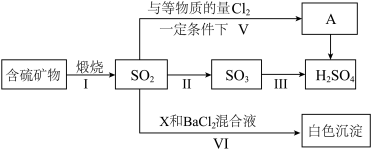
(1)若含硫矿物为黄铁矿(
 ),则途径Ⅰ煅烧得到的还原产物为
),则途径Ⅰ煅烧得到的还原产物为(2)途径Ⅱ的反应为
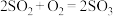 ,该反应在
,该反应在 催化作用下,反应分两步完成。已知第一步反应为:
催化作用下,反应分两步完成。已知第一步反应为: ;写出第二步反应化学方程式
;写出第二步反应化学方程式(3)下列有关说法
A. 通入石蕊试液中,先变红后褪色 通入石蕊试液中,先变红后褪色 |
B.工业上途径Ⅲ常用浓 吸收 吸收 制硫酸 制硫酸 |
C.食品中添加适量的 可以起到防腐作用 可以起到防腐作用 |
| D.铜与浓硫酸反应中,仅体现浓硫酸的强氧化性 |
(4)若白色沉淀为
 ,则X可能是
,则X可能是 ,则X可能是
,则X可能是(5)已知A与水作用能得到
 和另一种强酸,则物质A的化学式为
和另一种强酸,则物质A的化学式为
您最近一年使用:0次
8 . 实验室中利用 、
、 、
、 制取
制取 ,下列有关说法正确的是
,下列有关说法正确的是
 、
、 、
、 制取
制取 ,下列有关说法正确的是
,下列有关说法正确的是A. 和 和 可相互转化,互称为同位素 可相互转化,互称为同位素 |
B.若利用 制 制 ,常用 ,常用 做氧化剂 做氧化剂 |
C. 、 、 分解制取 分解制取 ,两种反应物既是氧化剂又是还原剂 ,两种反应物既是氧化剂又是还原剂 |
D.三个反应分别产生等物质的量的 ,转移的电子数相同 ,转移的电子数相同 |
您最近一年使用:0次
9 . 铬、钥在工业生产中具有重要的应用,从红铬矿渣(主要含有 和
和 ,还含有少量铁、铝、硅等氧化物)中分离提取铬和钒的一种流程如图所示:
,还含有少量铁、铝、硅等氧化物)中分离提取铬和钒的一种流程如图所示: 范围如下表。
范围如下表。
回答下列问题:
(1)“焙烧”前需要研磨的目的是___________ ,若焙烧后铬与钒均生成其最高价含氧酸盐,请写出 焙烧生成
焙烧生成 的化学方程式:
的化学方程式:___________ 。
(2)“溶浸渣”的主要成分是___________ (写化学式),第一次“调 ”的范围为
”的范围为___________ 。
(3)在实验室中模拟“除硅”后的分离操作中所用到的玻璃仪器有___________ 、___________ 和烧杯。
(4)已知焙烧后钒以 形式存在,“提取钒”步骤中,将溶液
形式存在,“提取钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为___________ ,此时铬元素的主要存在形式为___________ 。
(5)若最终得到氢氧化铬的沉淀质量为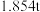 ,第三次“调
,第三次“调 ”时铬元素只有
”时铬元素只有 的沉淀分离出来,则“还原”步骤理论上转移的电子数为
的沉淀分离出来,则“还原”步骤理论上转移的电子数为___________ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(6)一种含钒的氧化物晶胞结构如图所示,已知 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 和
和 ,还含有少量铁、铝、硅等氧化物)中分离提取铬和钒的一种流程如图所示:
,还含有少量铁、铝、硅等氧化物)中分离提取铬和钒的一种流程如图所示: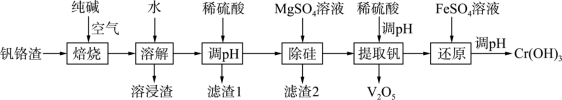
 范围如下表。
范围如下表。| 物质 |  |  |  |  |  |
开始沉淀的 | 4.6 | 7.5 | 1.9 | 4.1 |  |
完全沉淀的 | 5.9 | 9.0 | 3.2 | 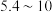 |
(1)“焙烧”前需要研磨的目的是
 焙烧生成
焙烧生成 的化学方程式:
的化学方程式:(2)“溶浸渣”的主要成分是
 ”的范围为
”的范围为(3)在实验室中模拟“除硅”后的分离操作中所用到的玻璃仪器有
(4)已知焙烧后钒以
 形式存在,“提取钒”步骤中,将溶液
形式存在,“提取钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为(5)若最终得到氢氧化铬的沉淀质量为
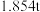 ,第三次“调
,第三次“调 ”时铬元素只有
”时铬元素只有 的沉淀分离出来,则“还原”步骤理论上转移的电子数为
的沉淀分离出来,则“还原”步骤理论上转移的电子数为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(6)一种含钒的氧化物晶胞结构如图所示,已知
 表示阿伏加德罗常数的值,则该晶体的密度为
表示阿伏加德罗常数的值,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
10 . 以辉锑矿(主要成分为 ,还含有
,还含有 )为原料提取金属
)为原料提取金属 的部分流程如下图所示:
的部分流程如下图所示: ;“水解”最终产物为
;“水解”最终产物为 固体;
固体;
②难溶物的部分数值如下:
下列有关说法正确的是
 ,还含有
,还含有 )为原料提取金属
)为原料提取金属 的部分流程如下图所示:
的部分流程如下图所示: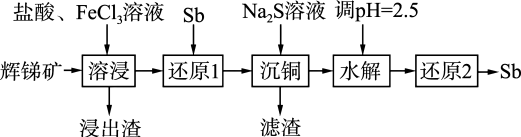
 ;“水解”最终产物为
;“水解”最终产物为 固体;
固体;②难溶物的部分数值如下:
| 物质 |  |  |  | 物质 |  |  |
开始沉淀 | 1.9 | 7.5 | 4.2 |  | 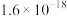 |  |
完全沉淀 | 3.2 | 9.0 | 6.7 |
A.“浸出渣”为 ,“滤渣”为 ,“滤渣”为 |
B.“还原1”发生反应的离子方程式为 |
C.“沉铜”时,若溶液中的阳离子的浓度均为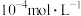 ,为保证只有铜离子沉出,则溶液中 ,为保证只有铜离子沉出,则溶液中 最大为 最大为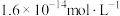 |
D.为了使“水解”时产物的纯度高,可通入 气体 气体 |
您最近一年使用:0次



