名校
解题方法
1 . 合成氨技术对全球农业、工业和医药等领域都产生了重大影响。一种以N2和H2为原料光催化合成氨气的部分原理如图,其中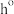 表示失去电子后带正电的空穴,
表示失去电子后带正电的空穴,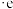 表示电子。下列说法错误的是
表示电子。下列说法错误的是
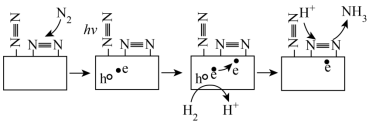
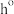 表示失去电子后带正电的空穴,
表示失去电子后带正电的空穴,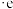 表示电子。下列说法错误的是
表示电子。下列说法错误的是
| A.反应过程中,N2得电子 |
| B.图示反应过程中有极性键和非极性键的断裂与形成 |
| C.每生成17gNH3,转移3mol电子 |
| D.标准状况下,相同体积的N2和NH3的物质的量相同 |
您最近一年使用:0次
2024-01-25更新
|
114次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高一上学期1月期末化学试题
2 . Ⅰ.完成下列问题
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
(2)为实现下列物质之间的转化,需要加入还原剂才能实现的是_______
(3)硫单质在反应3S+6KOH 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______
(4)3Cl2+6KOH(浓) KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
(5)神舟十三号载人飞船的燃料可为肼(N2H4),发射时发生的反应为:2N2H4+N2O4=3N2+4H2O,下列说法正确的是
(6)某溶液中可能含有H+、Fe2+、Na+、CO 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓) KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。
(7)用单线桥标出电子转移的方向和数目___________ 。
(8)此反应中,氧化剂为:___________ (填化学式),被氧化的元素为___________ 。
(9)此反应中,氧化产物与还原产物的质量之比为:___________ 。
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为___________ 个。
(1)我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,人之亦化为铜。”该炼制过程中没有涉及到的变化是_______
| A.复分解反应 | B.离子反应 | C.置换反应 | D.蒸发结晶 |
| A.KClO3→KCl | B.CuO→Cu | C.Cu→Cu(NO3)2 | D.HCO →CO2 →CO2 |
 2K2S+K2SO3+3H2O中的变化是_______
2K2S+K2SO3+3H2O中的变化是_______| A.被氧化 | B.被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
 KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为_______| A.1:5 | B.4:1 | C.5:1 | D.1:4 |
| A.肼在反应中作氧化剂 |
| B.反应中每生成1个H2O转移4个电子 |
| C.N2O4在反应中被氧化 |
| D.氧化产物与还原产物的物质的量之比是2:1 |
 、SO
、SO 、NO
、NO ,若H+和NO
,若H+和NO 的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______
的浓度分别为0.1mol·L-1、0.12mol·L-1,则溶液中一定大量存在_______| A.Fe2+ | B.Na+ | C.CO | D.SO |
Ⅱ.实验室用100mL浓盐酸跟足量的KClO3固体共热制取Cl2,反应的化学方程式为:KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O。
KCl+3Cl2↑+3H2O。(7)用单线桥标出电子转移的方向和数目
(8)此反应中,氧化剂为:
(9)此反应中,氧化产物与还原产物的质量之比为:
(10)当有3.36L(STP)Cl2生成时,反应中转移的电子数为
您最近一年使用:0次
名校
3 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近一年使用:0次
4 . 实验中常用离子反应:2Mn2++5NaBiO3+14H+=2MnO2+5Bi2++5Na++7H2O来检验Mn2+。下列叙述错误的是
| A.钠盐不一定易溶于水 | B.还原性:Mn2+>Bi3+ |
| C.生成1molNa+转移5mol电子 | D.氧化产物与氧化剂的物质的量之比为2:5 |
您最近一年使用:0次
名校
解题方法
5 . 中国炼丹家以炉甘石(ZnCO3)、赤铜矿(主要成分为Cu2O)和木炭粉为原料,混合加热可制得与黄金相似的鍮石金(一种金属合金)。将少量的炉甘石和赤铜矿加入到足量的稀盐酸中,生成无色无味的气体和红色固体,溶液变蓝色,氧化产物和还原产物的物质的量之比为1∶1,下列说法错误的是
| A.赤铜矿为纯净物 |
| B.ZnCO3+2H+=Zn2++CO2↑+H2O |
| C.Cu2O+2H+=Cu2++Cu+H2O |
| D.制备鍮石金的过程中,至少发生两个氧化还原反应 |
您最近一年使用:0次
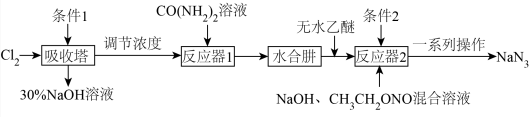
6 . 已知:碱性NaClO(受热易分解)溶液与 溶液反应生成
溶液反应生成 (水合肼,易溶于水,具有强还原性)。实验室利用
(水合肼,易溶于水,具有强还原性)。实验室利用 制取NaClO,从而进一步制得水合肼,并制取叠氮化钠(
制取NaClO,从而进一步制得水合肼,并制取叠氮化钠( ,不溶于乙醚,微溶于乙醇,易溶于水)的流程如图所示。下列说法错误的是
,不溶于乙醚,微溶于乙醇,易溶于水)的流程如图所示。下列说法错误的是
 溶液反应生成
溶液反应生成 (水合肼,易溶于水,具有强还原性)。实验室利用
(水合肼,易溶于水,具有强还原性)。实验室利用 制取NaClO,从而进一步制得水合肼,并制取叠氮化钠(
制取NaClO,从而进一步制得水合肼,并制取叠氮化钠( ,不溶于乙醚,微溶于乙醇,易溶于水)的流程如图所示。下列说法错误的是
,不溶于乙醚,微溶于乙醇,易溶于水)的流程如图所示。下列说法错误的是
| A.条件1和条件2均为冰水冷却,目的相同 |
| B.“调节浓度”的目的是防止水合肼被氧化 |
| C.反应器2中加入无水乙醚促进叠氮化钠析出 |
D.反应器2中生成39g ,则理论上转移2mol电子 ,则理论上转移2mol电子 |
您最近一年使用:0次
7 . 硫酸亚铁晶体( )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
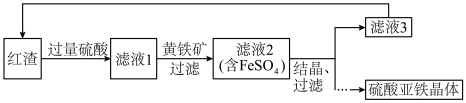
(1)红渣和硫酸发生反应的离子方程式是______ 。
(2)硫酸浸取后过滤,滤渣中含有______ (填化学式)。
(3)黄铁矿的主要成分是 ,其作用是
,其作用是______ 。
(4)流程中可循环利用的物质有______ 、 。
。
(5)若用含 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是______ 和______ 。
(6)产品纯度测定
已知:
取 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入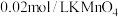 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是______ ( 的摩尔质量是
的摩尔质量是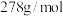 )。
)。
Ⅱ.用制备颜料铵铁蓝.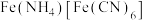
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和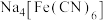 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀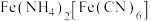 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:____
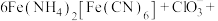 ______
______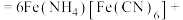 ______+______+______
______+______+______
 )是一种重要的无机化工原料,应用广泛。
)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的红渣(主要成分为
 ,含有少量
,含有少量 等)为原料生产硫酸亚铁晶体的工艺流程如下。
等)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)红渣和硫酸发生反应的离子方程式是
(2)硫酸浸取后过滤,滤渣中含有
(3)黄铁矿的主要成分是
 ,其作用是
,其作用是(4)流程中可循环利用的物质有
 。
。(5)若用含
 的滤液3制备
的滤液3制备 ,可选用的试剂是
,可选用的试剂是(6)产品纯度测定
已知:

取
 硫酸亚铁晶体产品,用稀
硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入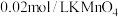 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液
溶液 。
。 的质量分数是
的质量分数是 的摩尔质量是
的摩尔质量是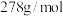 )。
)。Ⅱ.用制备颜料铵铁蓝.
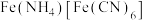
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和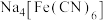 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀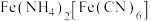 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: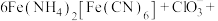 ______
______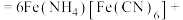 ______+______+______
______+______+______
您最近一年使用:0次
名校
解题方法
8 . 氯气是一种重要的化工原料;可用于制备许多化合物。现用下图装置制取氯气并以氯气为原料制备其他物质。
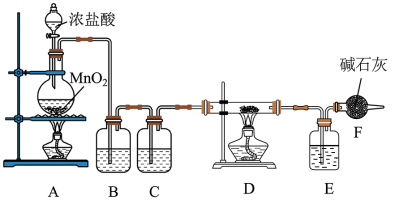
回答下列问题:
(1)装置A中圆底烧瓶内发生反应的离子方程式是___________ 。反应中HCl体现的性质是___________ 。
(2)若用D装置使氯气与铁粉反应制取少量氯化铁固体( 易吸水,在
易吸水,在 时升华),则:
时升华),则:
①装置B内盛装试剂为___________ ,作用是___________ 。
②装置C内盛装试剂为___________ 。
③D、E间导管短且粗的原因是___________ 。
④F装置的作用是___________ 。
(3)已知氯气与浓的NaOH溶液在加热条件下会生成 和NaCl,请写出该反应方程式:
和NaCl,请写出该反应方程式:___________ 。

回答下列问题:
(1)装置A中圆底烧瓶内发生反应的离子方程式是
(2)若用D装置使氯气与铁粉反应制取少量氯化铁固体(
 易吸水,在
易吸水,在 时升华),则:
时升华),则:①装置B内盛装试剂为
②装置C内盛装试剂为
③D、E间导管短且粗的原因是
④F装置的作用是
(3)已知氯气与浓的NaOH溶液在加热条件下会生成
 和NaCl,请写出该反应方程式:
和NaCl,请写出该反应方程式:
您最近一年使用:0次
名校
9 . 国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)金属钠等活泼金属着火时,应该用___________ 来灭火,不能用水灭火的原因是___________ 。
(2)用下面方法可以制得白色的 沉淀。
沉淀。
用不含 的
的 溶液与用不含
溶液与用不含 的蒸馏水配制的NaOH溶液反应制备。
的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述 溶液时还需加入
溶液时还需加入___________ 。
②除去蒸馏水中溶解的 常采用
常采用___________ 的方法。
③如果没有除去氧气会看到白色沉淀变为红褐色沉淀,该反应的化学方程式为___________ 。
(3)某化工厂的贮氯罐意外发生泄漏,消防员向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式是___________ 。为了安全,组织群众疏散的地方应是___________ (填序号)。
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处
(4)二氧化氯( )是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与
)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与 相比不会产生对人体有潜在危害的有机氯代物。可以由
相比不会产生对人体有潜在危害的有机氯代物。可以由 、
、 、
、 制备
制备 :
:
①配平下列方程式:___________


②上述反应中氧化剂是___________ 。
③若反应中有0.1mol电子转移,则产生的 气体在标准状况下的体积约为
气体在标准状况下的体积约为___________ L。
(1)金属钠等活泼金属着火时,应该用
(2)用下面方法可以制得白色的
 沉淀。
沉淀。用不含
 的
的 溶液与用不含
溶液与用不含 的蒸馏水配制的NaOH溶液反应制备。
的蒸馏水配制的NaOH溶液反应制备。①用硫酸亚铁晶体配制上述
 溶液时还需加入
溶液时还需加入②除去蒸馏水中溶解的
 常采用
常采用③如果没有除去氧气会看到白色沉淀变为红褐色沉淀,该反应的化学方程式为
(3)某化工厂的贮氯罐意外发生泄漏,消防员向贮氯罐周围空气中喷洒稀NaOH溶液,发生反应的离子方程式是
A.顺风高坡处 B.逆风高坡处 C.顺风低洼处 D.逆风低洼处
(4)二氧化氯(
 )是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与
)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与 相比不会产生对人体有潜在危害的有机氯代物。可以由
相比不会产生对人体有潜在危害的有机氯代物。可以由 、
、 、
、 制备
制备 :
:①配平下列方程式:


②上述反应中氧化剂是
③若反应中有0.1mol电子转移,则产生的
 气体在标准状况下的体积约为
气体在标准状况下的体积约为
您最近一年使用:0次
名校
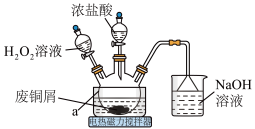
10 . CuCl2是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl2·2H2O并开展相关探究。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)上述方法制备CuCl2的离子方程式为___________ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入 气体,加热蒸发浓缩,
气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。持续通入 气体的目的是
气体的目的是___________ 。
(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:___________ ;原因2:生成的CuCl2催化了H2O2的分解。
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:___________ (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:___________ 。
③分析上述实验,下列说法正确的是___________ (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B. 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用
C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途___________ 。
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)上述方法制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入
 气体,加热蒸发浓缩,
气体,加热蒸发浓缩, 气体的目的是
气体的目的是(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
| 实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 滴加试剂 | 2滴1mol/LNaCl | 2滴1mol/LNa2SO4 | 2滴1mol/LCuSO4 | 2滴1mol/LCuSO4和2滴1mol/LNaCl | 2滴1mol/LCuSO4和4滴1mol/LNaCl |
| 现象 | 无气泡产生 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快 | ||
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:
③分析上述实验,下列说法正确的是
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B.
 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途
您最近一年使用:0次



