名校
1 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.电解水制备法 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:
(1)基态铜原子的价层电子轨道表示式为___________ 。
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为___________ 。
②推测醛氧化制氢所需电压比电解水制氢___________ (填“低”、“高”或“相同”)。
③补全醛催化氧化时,阳极的电极反应式:___________ 。
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成 的物质的量为
的物质的量为___________ 。
Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为: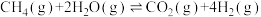

(4)达到平衡后通入氮气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因___________ 。
(5)反应的过程中发生副反应
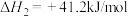 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是___________ 。
I.电解水制备法

 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:(1)基态铜原子的价层电子轨道表示式为
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为
②推测醛氧化制氢所需电压比电解水制氢
③补全醛催化氧化时,阳极的电极反应式:
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成
 的物质的量为
的物质的量为Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为:
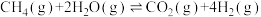

(4)达到平衡后通入氮气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(5)反应的过程中发生副反应

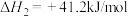 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是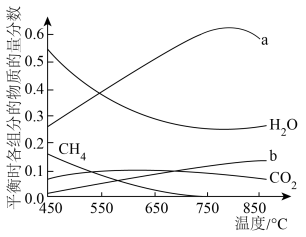
您最近一年使用:0次
2024-03-03更新
|
128次组卷
|
3卷引用: 北京市第十二中学2023-2024学年高二下学期开学考试化学试题
名校
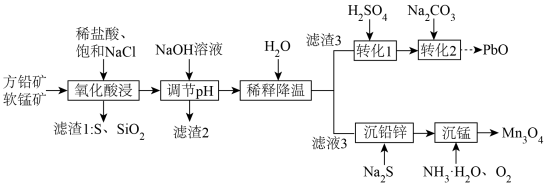
2 . 一种以方铅矿(主要成分为 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:① 。
。
②常温下,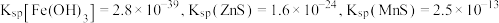 ,
, 。
。
(1) 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是___________ (填元素符号)。
(2)“氧化酸浸”时, 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为___________ 。随着温度的升高,各元素的浸出率变化如图所示,当温度高于 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是___________ 。

(3)“调节 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分___________ 。
(4)结合平衡移动原理,解释“稀释降温”的目的:___________ 。
(5)“滤液3”中的金属阳离子除了少量 外,还有
外,还有___________ 。
(6)常温下,用 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为___________  (设
(设 的平衡浓度为
的平衡浓度为 )。
)。
(7)一定条件下,写出“沉锰”制备 的化学方程式
的化学方程式___________ 。
 ,含少量
,含少量 等)和软锰矿(主要成分为
等)和软锰矿(主要成分为 )为原料协同提取铅、锰的工艺流程如图所示。
)为原料协同提取铅、锰的工艺流程如图所示。
已知:①
 。
。②常温下,
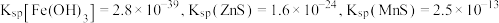 ,
, 。
。(1)
 与
与 相比,基态原子的第三电离能更大的元素是
相比,基态原子的第三电离能更大的元素是(2)“氧化酸浸”时,
 发生反应生成
发生反应生成 的离子方程式为
的离子方程式为 后,
后, 浸出率不升反降,可能的原因是
浸出率不升反降,可能的原因是
(3)“调节
 ”至
”至 ,滤渣2的主要成分
,滤渣2的主要成分(4)结合平衡移动原理,解释“稀释降温”的目的:
(5)“滤液3”中的金属阳离子除了少量
 外,还有
外,还有(6)常温下,用
 的
的 溶液“沉铅锌”时,当
溶液“沉铅锌”时,当 时,溶液中
时,溶液中 浓度为
浓度为 (设
(设 的平衡浓度为
的平衡浓度为 )。
)。(7)一定条件下,写出“沉锰”制备
 的化学方程式
的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 物质的氧化性和还原性与溶液 有关,具体可用
有关,具体可用 电势图来表征,电势越大,氧化性越强,铬元素的
电势图来表征,电势越大,氧化性越强,铬元素的 电势图如图所示,下列说法错误的是
电势图如图所示,下列说法错误的是

 有关,具体可用
有关,具体可用 电势图来表征,电势越大,氧化性越强,铬元素的
电势图来表征,电势越大,氧化性越强,铬元素的 电势图如图所示,下列说法错误的是
电势图如图所示,下列说法错误的是
A. 被氧化均生成 被氧化均生成 (Ⅲ) (Ⅲ) |
B. 线的反应为: 线的反应为: |
C. 值越大 值越大 越容易被氧化 越容易被氧化 |
D. 时, 时,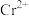 可与 可与 反应生成 反应生成 |
您最近一年使用:0次
名校
解题方法
4 . 以金红石(主要成分为 ,含杂质
,含杂质 等)为原料“碳氯化法”高温生产钛的主要流程如下,下列说法错误的是
等)为原料“碳氯化法”高温生产钛的主要流程如下,下列说法错误的是

 ,含杂质
,含杂质 等)为原料“碳氯化法”高温生产钛的主要流程如下,下列说法错误的是
等)为原料“碳氯化法”高温生产钛的主要流程如下,下列说法错误的是
A.向粉碎后的固体中鼓入 使其“沸腾”有助于充分反应 使其“沸腾”有助于充分反应 |
B.在沸腾氯化炉中, 参加反应转移电子数为 参加反应转移电子数为 |
C.“碳氯化法”得到的 液体中混有杂质 液体中混有杂质 ,可蒸馏分离 ,可蒸馏分离 |
D.可用活泼金属 等在空气中加热还原 等在空气中加热还原 制备 制备 |
您最近一年使用:0次
解题方法
5 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近一年使用:0次
名校
6 . 亚氯酸钠( )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
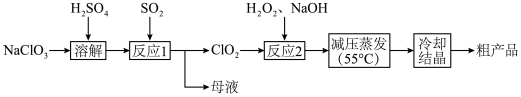
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①实验室购买的浓硫酸标签如图所示。配制所需的 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有___________ ,需要量取的浓硫酸的体积是___________ mL。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中
③配制过程中下列各项操作可能导致浓度偏小的有___________ (填写字母)。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是___________ 。
(3)“反应2”中加入的 的电子式是
的电子式是___________ ,发生反应的离子方程式是___________ 。
 )主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠(
)主要用于棉纺、造纸业,也用于食品消毒、水处理等,以氯酸钠( )等为原料制备亚氯酸钠(
)等为原料制备亚氯酸钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)实验室模拟“溶解”过程,需要480 mL 0.1 mol/L
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①实验室购买的浓硫酸标签如图所示。配制所需的
 溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有
溶液用到的仪器有烧杯、量筒,还缺少的玻璃仪器有| 硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
A.使用容量瓶前检查容量瓶的气密性是否良好
B.容量瓶用蒸馏水洗净后无需干燥即可使用
C.浓硫酸的稀释可以在容量瓶中进行
D.配制好的
 溶液可以长期存放在容量瓶中
溶液可以长期存放在容量瓶中③配制过程中下列各项操作可能导致浓度偏小的有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.将浓硫酸稀释后立即转入容量瓶后,立即进行后续实验操作
C.转移溶液时,不慎有少量溶液洒到容量瓶外面
D.定容时,俯视容量瓶刻度线进行定容
(2)“反应1”中氧化剂和还原剂的物质的量之比是
(3)“反应2”中加入的
 的电子式是
的电子式是
您最近一年使用:0次
7 . 元素铬(Cr)为钢灰色金属,是自然界硬度最大的金属,可溶于水的化合物有 和
和 ,回答下列问题:
,回答下列问题:
(1)写出 溶于水电离方程式
溶于水电离方程式_______ 。
(2)水溶液中发生的化学反应: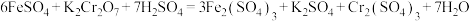 ,该反应中共有
,该反应中共有_______ 种盐,其中氧化剂是_______ ,氧化产物是_______ ,氧化剂和还原剂的物质的量之比为_______ ,用双线桥法标出该反应电子转移的方向和数目:_______ 。
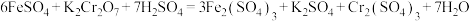
将该化学方程式改为离子方程式_______ 。
(3)铬元素的化合价有+6、+3,在下图所示步骤中,发生氧化反应的是_______ (填序号,下同),发生还原反应的是_______ ,既没发生氧化反应又没发生还原反应的是_______ 。

(4)向橙色的酸性 溶液通入足量的
溶液通入足量的 气体,溶液变为绿色的
气体,溶液变为绿色的 溶液,此反应中利用
溶液,此反应中利用 的
的_______ (填“漂白性”“酸性”“氧化性”或“还原性”)。
 和
和 ,回答下列问题:
,回答下列问题:(1)写出
 溶于水电离方程式
溶于水电离方程式(2)水溶液中发生的化学反应:
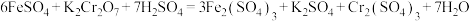 ,该反应中共有
,该反应中共有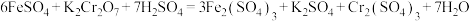
将该化学方程式改为离子方程式
(3)铬元素的化合价有+6、+3,在下图所示步骤中,发生氧化反应的是

(4)向橙色的酸性
 溶液通入足量的
溶液通入足量的 气体,溶液变为绿色的
气体,溶液变为绿色的 溶液,此反应中利用
溶液,此反应中利用 的
的
您最近一年使用:0次
名校
8 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近一年使用:0次
2024-03-02更新
|
69次组卷
|
2卷引用:安徽省灵璧中学名校联考2023-2024学年高一上学期1月阶段性考试化学试题
名校
解题方法
9 . 如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
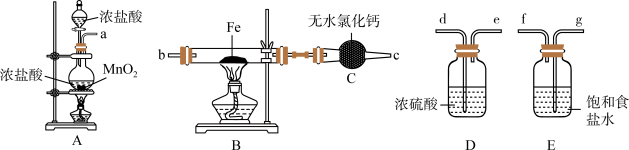
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E的作用是___________ 。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为___________ 。
(5)利用制取的无水氯化铁固体配制少量 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为___________ ;溶解所得溶液中含有 的原因可能是
的原因可能是___________ 。
②向沸水中滴加少量 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至___________ (填实验现象)时停止,得到 胶体。
胶体。

回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
(2)装置A中发生反应的离子方程式为
(3)装置E的作用是
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装有
 溶液的烧杯吸收尾气,发生反应的化学方程式为
溶液的烧杯吸收尾气,发生反应的化学方程式为(5)利用制取的无水氯化铁固体配制少量
 饱和溶液并制备
饱和溶液并制备 胶体。
胶体。①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为
 的原因可能是
的原因可能是②向沸水中滴加少量
 饱和溶液,继续煮沸,至
饱和溶液,继续煮沸,至 胶体。
胶体。
您最近一年使用:0次
2024-03-02更新
|
88次组卷
|
2卷引用:内蒙古自治区乌兰浩特第一中学2023-2024学年高一上学期期末考试化学试题
名校
10 .  在中性或碱性溶液中稳定,在酸性溶液中不稳定。由S和
在中性或碱性溶液中稳定,在酸性溶液中不稳定。由S和 溶液制备硫代硫酸钠的反应为
溶液制备硫代硫酸钠的反应为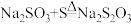 。实验室常用的制备方法是向
。实验室常用的制备方法是向 和
和 的混合溶液中通入
的混合溶液中通入 ,制备
,制备 晶体的实验步骤如下:
晶体的实验步骤如下:
①将含有煤粉的工业硫化钠提纯得到硫化的晶体( )。
)。
②按图安装制备硫代硫酸钠的装置,并检查装置的气密性。

③称取提纯后的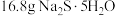 ,
,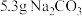 ,放入250mL锥形瓶中,加入150mL蒸馏水使其溶解。
,放入250mL锥形瓶中,加入150mL蒸馏水使其溶解。
④打开分液漏斗,使70%浓硫酸慢慢滴下。打开螺旋夹,使反应产生的气体均匀地通入 、
、 的混合溶液中,并用电磁搅拌器搅拌。随着气体的通入,逐渐有大量浅黄色固体析出。继续通入
的混合溶液中,并用电磁搅拌器搅拌。随着气体的通入,逐渐有大量浅黄色固体析出。继续通入 气体,浅黄色固体逐渐减少,反应进行约1h,控制锥形瓶中混合溶液的pH不小于7。
气体,浅黄色固体逐渐减少,反应进行约1h,控制锥形瓶中混合溶液的pH不小于7。
⑤过滤锥形瓶中的混合溶液,蒸发浓缩滤液至有晶体析出,停止蒸发,冷却,析出 晶体,过滤、洗涤、干燥,称量得到27.9g产品。
晶体,过滤、洗涤、干燥,称量得到27.9g产品。
回答下列问题:
(1)将含有煤粉的工业硫化钠提纯得到 的操作如下,正确的顺序是
的操作如下,正确的顺序是________ (填字母)。
A.趁热过滤 B.加热溶解 C.过滤、洗涤,干燥 D.冷却结晶
(2)实验室称量硫化钠晶体和 的质量需要使用的主要仪器有镊子、药匙、砝码、称量瓶和
的质量需要使用的主要仪器有镊子、药匙、砝码、称量瓶和_____ 。
(3)向锥形瓶中通入 气体时,若观察到锥形瓶中出现倒吸现象,可以
气体时,若观察到锥形瓶中出现倒吸现象,可以___________ (填操作)防止倒吸。锥形瓶中小磁铁的作用是______________________________ 。
(4) 与
与 反应析出浅黄色固体的化学方程式为
反应析出浅黄色固体的化学方程式为___________________ ;能说明锥形瓶中溶液与 气体发生放热反应的依据是
气体发生放热反应的依据是_________________________ ;控制锥形瓶中混合溶液的pH不小于7的原因是____________ 。
(5)硫代硫酸钠晶体( )的产率为
)的产率为__________ 。
 在中性或碱性溶液中稳定,在酸性溶液中不稳定。由S和
在中性或碱性溶液中稳定,在酸性溶液中不稳定。由S和 溶液制备硫代硫酸钠的反应为
溶液制备硫代硫酸钠的反应为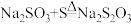 。实验室常用的制备方法是向
。实验室常用的制备方法是向 和
和 的混合溶液中通入
的混合溶液中通入 ,制备
,制备 晶体的实验步骤如下:
晶体的实验步骤如下:①将含有煤粉的工业硫化钠提纯得到硫化的晶体(
 )。
)。②按图安装制备硫代硫酸钠的装置,并检查装置的气密性。

③称取提纯后的
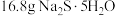 ,
,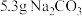 ,放入250mL锥形瓶中,加入150mL蒸馏水使其溶解。
,放入250mL锥形瓶中,加入150mL蒸馏水使其溶解。④打开分液漏斗,使70%浓硫酸慢慢滴下。打开螺旋夹,使反应产生的气体均匀地通入
 、
、 的混合溶液中,并用电磁搅拌器搅拌。随着气体的通入,逐渐有大量浅黄色固体析出。继续通入
的混合溶液中,并用电磁搅拌器搅拌。随着气体的通入,逐渐有大量浅黄色固体析出。继续通入 气体,浅黄色固体逐渐减少,反应进行约1h,控制锥形瓶中混合溶液的pH不小于7。
气体,浅黄色固体逐渐减少,反应进行约1h,控制锥形瓶中混合溶液的pH不小于7。⑤过滤锥形瓶中的混合溶液,蒸发浓缩滤液至有晶体析出,停止蒸发,冷却,析出
 晶体,过滤、洗涤、干燥,称量得到27.9g产品。
晶体,过滤、洗涤、干燥,称量得到27.9g产品。回答下列问题:
(1)将含有煤粉的工业硫化钠提纯得到
 的操作如下,正确的顺序是
的操作如下,正确的顺序是A.趁热过滤 B.加热溶解 C.过滤、洗涤,干燥 D.冷却结晶
(2)实验室称量硫化钠晶体和
 的质量需要使用的主要仪器有镊子、药匙、砝码、称量瓶和
的质量需要使用的主要仪器有镊子、药匙、砝码、称量瓶和(3)向锥形瓶中通入
 气体时,若观察到锥形瓶中出现倒吸现象,可以
气体时,若观察到锥形瓶中出现倒吸现象,可以(4)
 与
与 反应析出浅黄色固体的化学方程式为
反应析出浅黄色固体的化学方程式为 气体发生放热反应的依据是
气体发生放热反应的依据是(5)硫代硫酸钠晶体(
 )的产率为
)的产率为
您最近一年使用:0次



