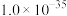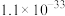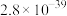名校
解题方法
1 . 研究小组制备次氯酸钠(NaClO)、探究其性质并测定其物质的量浓度。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为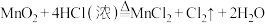 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为_________ 。
(2)B中饱和NaCl溶液的作用是________ 。
(3)C为NaClO制备装置,反应的离子方程式为_______ 。
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于________ ,可能与某些酸反应。小组同学将红色纸条浸入NaClO溶液后,纸条褪色,向溶液中通入 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成_______ (写化学式)。
(5)NaClO具有氧化性,预测依据是_______ 。小组同学向NaClO溶液中加入过量的KI溶液,加入适量稀硫酸,加入淀粉,溶液变蓝,无黄绿色气体产生。该反应的离子方程式为_______ 。
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制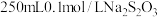 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。
(6)计算需要 固体的质量是
固体的质量是_____ g。
(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______ 。
(8)下列情况中,会使所配溶液浓度偏小的是___________ (填字母)。
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。
(9)计算NaClO溶液的物质的量浓度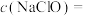
______ mol/L。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为
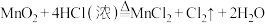 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为(2)B中饱和NaCl溶液的作用是
(3)C为NaClO制备装置,反应的离子方程式为
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于
 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成(5)NaClO具有氧化性,预测依据是
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制
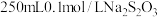 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。(6)计算需要
 固体的质量是
固体的质量是(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
(8)下列情况中,会使所配溶液浓度偏小的是
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用
 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。(9)计算NaClO溶液的物质的量浓度
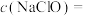
您最近一年使用:0次
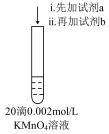
2 . 小组同学探究金属钠与KMnO4溶液的反应。
①向KMnO4溶液中投入一小块金属钠,溶液颜色略有变浅;继续依次投入五小块金属钠,溶液变为绿色,产生气体
②向KMnO4溶液中加入少量NaOH固体,溶液颜色无明显变化;继续加入NaOH固体,溶液变为绿色,产生气体
已知:Mn2+无色,MnO 绿色。
绿色。
对比①②,下列有关说法不正确的是
①向KMnO4溶液中投入一小块金属钠,溶液颜色略有变浅;继续依次投入五小块金属钠,溶液变为绿色,产生气体
②向KMnO4溶液中加入少量NaOH固体,溶液颜色无明显变化;继续加入NaOH固体,溶液变为绿色,产生气体
已知:Mn2+无色,MnO
 绿色。
绿色。对比①②,下列有关说法不正确的是
| A.①中溶液颜色变浅,说明KMnO4发生还原反应 |
B.①中溶液变为绿色,说明MnO 被钠还原为MnO 被钠还原为MnO |
C.②中溶液变为绿色,可能发生4MnO +4OH-=4MnO +4OH-=4MnO +O2↑+2H2O +O2↑+2H2O |
| D.②中溶液颜色变化表明,溶液pH会影响物质氧化性或还原性的强弱 |
您最近一年使用:0次
2024-03-01更新
|
107次组卷
|
3卷引用:北京九中2023-2024学年高一下学期开学测试化学试题
名校
解题方法
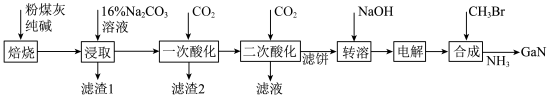
3 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度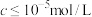 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、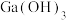 均为两性,
均为两性,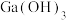 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: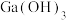 可溶于氨水中,
可溶于氨水中,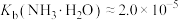 ,反应
,反应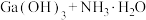
 的平衡常数
的平衡常数 ,计算反应
,计算反应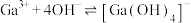 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
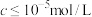 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、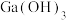 均为两性,
均为两性,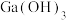 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
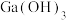 可溶于氨水中,
可溶于氨水中,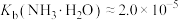 ,反应
,反应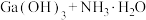
 的平衡常数
的平衡常数 ,计算反应
,计算反应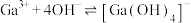 的平衡常数
的平衡常数
您最近一年使用:0次
2024高三下·全国·专题练习
4 . NaClO2的漂白能力是漂白粉的4~5倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
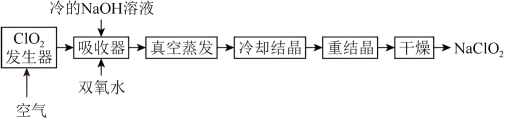
吸收器中生成NaClO2的离子反应方程式为___________ ,其中反应温度不能高于5℃的可能原因:___________ 。

吸收器中生成NaClO2的离子反应方程式为
您最近一年使用:0次
2024高三下·全国·专题练习
5 . 实验室用含有绿矾杂质的硫酸铜粗产品(含绿矾及不溶性杂质)制备纯净的胆矾,设计的实验步骤如下图所示。

已知溶液中A中加入H2O2,发生反应的离子方程式为___________ ,溶液B中加入NaOH溶液调到pH=4的目的是___________ ,操作Ⅰ是___________ ,操作Ⅱ是___________ 。

已知溶液中A中加入H2O2,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中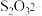 均被氧化为
均被氧化为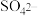 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中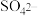 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
 ,氧化还原反应的影响。
,氧化还原反应的影响。资料:i.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ii.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。iii.
 为微溶物。
为微溶物。实验 | 序号 | 试剂 | 现象 |
| I | a:10滴 溶液 溶液b:20滴 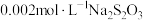 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 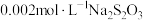 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴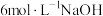 溶液 溶液b:2滴 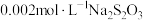 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴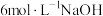 溶液 溶液b:20滴 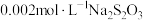 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
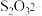 均被氧化为
均被氧化为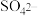 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
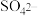 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。②实验VI:向实验IV的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。对比实验V、VI,结合方程式分析实验VI滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
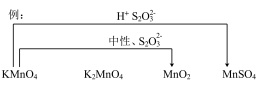
您最近一年使用:0次
2024-02-29更新
|
272次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
2024高三下·全国·专题练习
解题方法
7 . 氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(1)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(2)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

(1)粉碎机中,发生的变化属于
(2)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 某小组设计实验探究铜被碘氧化的产物及铜元素的价态。

已知:①I2易溶于KI溶液,发生反应I2+I- I
I (红棕色);
(红棕色);
②铜元素被氧化可能存在的形式有 [Cu(NH3)4]2+(蓝色)、[CuI2]-(无色);
③ [Cu(NH3)2]+(无色),易被空气氧化。
用离子方程式表示步骤II中发生的反应___________ 。

已知:①I2易溶于KI溶液,发生反应I2+I-
 I
I (红棕色);
(红棕色);②铜元素被氧化可能存在的形式有 [Cu(NH3)4]2+(蓝色)、[CuI2]-(无色);
③ [Cu(NH3)2]+(无色),易被空气氧化。
用离子方程式表示步骤II中发生的反应
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl和蚀刻液重新生成的流程如下:

已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇。
写出上述流程中生成CuCl的化学方程式___________ 。

已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇。
写出上述流程中生成CuCl的化学方程式
您最近一年使用:0次