解题方法
1 . 工业上可用以下方案使饮用水中 含量达标。
含量达标。
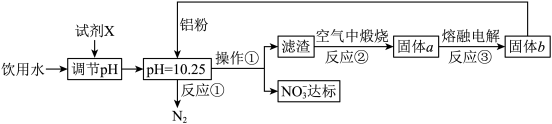
已知:滤渣的成分为Al(OH)3,pH>12时Al(OH)3开始溶解。
(1)流程中操作①的名称为___________ ,从经济角度考虑,试剂X可以选用___________ (请填字母)。
a.CuO b.Ca(OH)2 c.NH3
(2)请写出固体a的化学式___________ 。
(3)写出反应①中铝粉和 反应的离子方程式
反应的离子方程式___________ ;如果该溶液酸碱度调节至酸性过强或碱性过强,可能出现滤渣的质量减少,其原因可能是___________ 。
(4)如果在化学实验室中模拟反应②的进行,需要选择___________ (实验仪器)盛放Al(OH)3进行煅烧操作。
(5)也可以使用Fe2+与 反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是
反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是___________ (填序号)。
①容量瓶在使用前未干燥,里面有少量蒸馏水
②忘记将洗涤液转入容量瓶
③定容时俯视容量瓶刻度线
④定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
 含量达标。
含量达标。
已知:滤渣的成分为Al(OH)3,pH>12时Al(OH)3开始溶解。
(1)流程中操作①的名称为
a.CuO b.Ca(OH)2 c.NH3
(2)请写出固体a的化学式
(3)写出反应①中铝粉和
 反应的离子方程式
反应的离子方程式(4)如果在化学实验室中模拟反应②的进行,需要选择
(5)也可以使用Fe2+与
 反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是
反应,使其含量达标。FeC2O4(草酸亚铁)常用作分析试剂,在配制一定浓度FeC2O4溶液过程中,溶液的浓度将偏低的是①容量瓶在使用前未干燥,里面有少量蒸馏水
②忘记将洗涤液转入容量瓶
③定容时俯视容量瓶刻度线
④定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
2 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有______ (填序号,下同),属于非电解质的有______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为____________ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_________ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式:______ 。
______C+______K2Cr2O7+______H2SO4=______K2SO4+______CO2↑+______Cr2(SO4)3+______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为______ 。
③H2SO4在上述反应中表现出来的性质是______ (填选项编号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式:
______C+______K2Cr2O7+______H2SO4=______K2SO4+______CO2↑+______Cr2(SO4)3+______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
③H2SO4在上述反应中表现出来的性质是
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
您最近一年使用:0次
3 . 化学应该明白“从生活中来,到生活中去”的道理。家庭厨卫用品中有许多常见的化学物质,括号内为厨卫用品的主要成分:①食盐(NaCl)②蔗糖③食醋(3-5%醋酸)④碱粉(Na2CO3)⑤小苏打粉(NaHCO3)⑥84消毒液(NaClO)⑦洁厕灵液(HCl)⑧净水剂固体(明矾)⑨铁锅(Fe)
回答下列问题:
(1)明矾的化学式为KAl(SO4)2·12H2O,属于___________ (填“纯净物”或“混合物”)。
(2)厨卫用品中,能够导电的有___________。
(3)小苏打的主要成分NaHCO3在水溶液的电离方程式为___________ ;84消毒液的主要成分NaClO中含有的化学键有___________ 。
(4)除去Na2CO3固体中的NaHCO3涉及的化学方程式是___________ 。
(5)实验室需要配制0.200mol/L的Na2CO3溶液450mL。配制上述溶液时,需要Na2CO3固体的质量为___________ g;如果定容时俯视刻度,则所配溶液的浓度___________ (用“偏高”、“偏低”和“无影响”填空)。
(6)用双线桥法表示下面反应的电子转移方向和数目___________ 。
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
此反应的还原产物和氧化产物的物质的量之比为___________ 。
回答下列问题:
(1)明矾的化学式为KAl(SO4)2·12H2O,属于
(2)厨卫用品中,能够导电的有___________。
| A.①②③⑥⑦ | B.④⑤⑥⑦⑨ | C.③④⑤⑥⑦⑨ | D.③⑥⑦⑨ |
(4)除去Na2CO3固体中的NaHCO3涉及的化学方程式是
(5)实验室需要配制0.200mol/L的Na2CO3溶液450mL。配制上述溶液时,需要Na2CO3固体的质量为
(6)用双线桥法表示下面反应的电子转移方向和数目
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
此反应的还原产物和氧化产物的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 锗是当代高新技术产业配套的重要材料之一,从含锗烟尘中富集提取锗的一种工艺方法如下,其中烟尘中主要成分如表1所示:
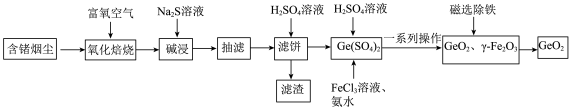
已知:i.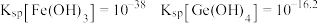
ii. 没有磁性,
没有磁性,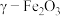 具有磁性。
具有磁性。
表1:含锗烟尘的主要成分
(1) 元素在周期表中的位置为:第
元素在周期表中的位置为:第___________ 周期第___________ 族。
(2)氧化焙烧时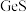 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:___________ 。
(3)抽滤的优点___________ 和___________ 。
(4)滤渣成分为 、
、___________ 和___________ 。
(5)碱浸时生成 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:_______ 。
(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节 的范围为
的范围为___________ 。
(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。
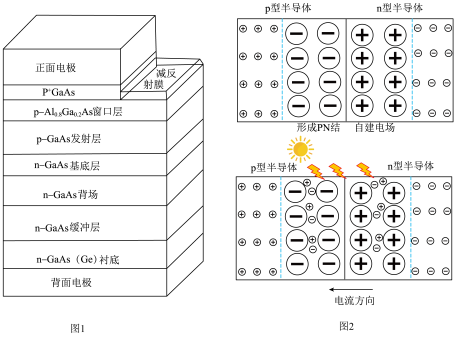
当光照射在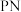 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至___________ 方向(填“p型半导体”或“n型半导体”)。

已知:i.
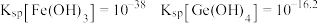
ii.
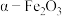 没有磁性,
没有磁性, 具有磁性。
具有磁性。表1:含锗烟尘的主要成分
| 成分 |  |  |  |  |  |  |  |
 | 0.97 | 49.43 | 13.70 | 11.07 | 8.76 | 2.97 | 1.60 |
(1)
 元素在周期表中的位置为:第
元素在周期表中的位置为:第(2)氧化焙烧时
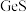 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:(3)抽滤的优点
(4)滤渣成分为
 、
、(5)碱浸时生成
 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节
 的范围为
的范围为(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。

当光照射在
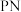 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
您最近一年使用:0次
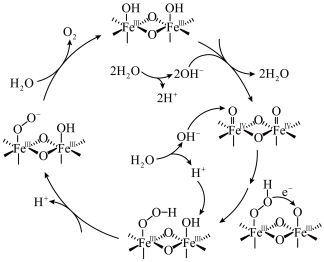
5 . 水氧化反应是水分解反应的决速步骤,章宇超团队利用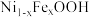 作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
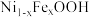 作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
作光催化剂,通过以下转化途径,显著提升光催化水氧化反应速率,为太阳能的高效利用提供了新的策略。下列有关说法正确的是
| A.转化途径中产生1个O2,理论上转移4个电子 |
| B.转化过程中化合态的O元素价态相同 |
| C.含Fe的化合物均为光电催化剂 |
| D.转化过程中光能最终全部转换为化学能 |
您最近一年使用:0次
解题方法
6 . 下图是某市售盐酸试剂瓶标签上的部分数据,请回答下列问题:
(1)用市售浓盐酸配制250mL 0.1 稀盐酸,配制过程中要用到的玻璃仪器有
稀盐酸,配制过程中要用到的玻璃仪器有_______ (填字母序号)。

(2)仪器E的名称是_______ ,其在使用前首先需要_______ 。
(3)市售盐酸的物质的量浓度是_______ (保留三位有效数字)。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
①洗净的容量瓶内有少量水:_______ 。
②用量筒量取浓盐酸时仰视刻度线:_______ 。
③搅拌稀释浓盐酸时有液体溅出烧杯:_______ 。
④定容时,俯视容量瓶的刻度线定容:_______ 。
(5)若将标准状况下体积为V L的HCl气体溶于1L水中,所得溶液的密度为 ,计算所得溶液中HCl的质量分数为
,计算所得溶液中HCl的质量分数为_______ ,HCl的物质的量浓度为_______  。
。
(6)新型消毒剂 可以用浓盐酸与
可以用浓盐酸与 溶液反应制备,反应的化学方程式为
溶液反应制备,反应的化学方程式为
 ,反应生成2mol
,反应生成2mol  转移的电子数为
转移的电子数为_______ ,还原剂和还原产物的物质的量之比为_______ 。
盐酸 化学式:HCl 相对分子质量:36.5 外观:合格 密度:1.18g·cm-3 HCl的质量分数:36.5% 符合GB622-89 |
(1)用市售浓盐酸配制250mL 0.1
 稀盐酸,配制过程中要用到的玻璃仪器有
稀盐酸,配制过程中要用到的玻璃仪器有
(2)仪器E的名称是
(3)市售盐酸的物质的量浓度是
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“无影响”)。
①洗净的容量瓶内有少量水:
②用量筒量取浓盐酸时仰视刻度线:
③搅拌稀释浓盐酸时有液体溅出烧杯:
④定容时,俯视容量瓶的刻度线定容:
(5)若将标准状况下体积为V L的HCl气体溶于1L水中,所得溶液的密度为
 ,计算所得溶液中HCl的质量分数为
,计算所得溶液中HCl的质量分数为 。
。(6)新型消毒剂
 可以用浓盐酸与
可以用浓盐酸与 溶液反应制备,反应的化学方程式为
溶液反应制备,反应的化学方程式为
 ,反应生成2mol
,反应生成2mol  转移的电子数为
转移的电子数为
您最近一年使用:0次
7 . 钛白粉(主要成分 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:

已知:“酸溶”后钛主要以 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成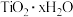
(1) 中
中 的化合价为
的化合价为___________ 。
(2)“酸溶”时主要成分发生反应的离子方程式为___________ ;废渣的主要成分为___________ 。
(3)“还原”时试剂X应选择合适的试剂是___________ ;常温下溶解度:
__________ 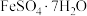 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(4)“氧化”时发生的主要反应化学方程式为___________ 。
(5)以上两种工艺流程中,循环使用的物质有___________ ;请说出方法一优于方法二的理由___________ (写出一条即可)。
(6)若钛铁矿中 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为___________ %(用含m的计算式表示)。
 )是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分
)是目前世界上被认为性能最好的白色颜料,其人均消费量也成为一个国家经济发展的重要指标。利用钛铁矿(主要成分 ,还有
,还有 、
、 、
、 等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
等杂质)为原料,通过硫酸法和氯化法两种生产工艺制备钛白粉的流程如图所示,请回答下列问题:
已知:“酸溶”后钛主要以
 形式存在,
形式存在, 在80°C左右水解生成
在80°C左右水解生成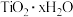
(1)
 中
中 的化合价为
的化合价为(2)“酸溶”时主要成分发生反应的离子方程式为
(3)“还原”时试剂X应选择合适的试剂是

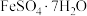 (填“大于”或“小于”)。
(填“大于”或“小于”)。(4)“氧化”时发生的主要反应化学方程式为
(5)以上两种工艺流程中,循环使用的物质有
(6)若钛铁矿中
 的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精
的质量分数约为19%,实验室用100g此种铁矿石利用方法一得到精 mg,则Ti元素的回收率为
mg,则Ti元素的回收率为
您最近一年使用:0次
解题方法
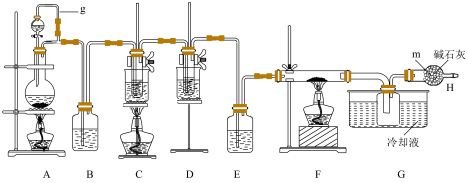
8 . 实验室可以用氯气制备多种物质,某化学小组在实验室制备 、NaClO和
、NaClO和 三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
(1)装置A中用 和浓盐酸反应制备
和浓盐酸反应制备 的离子方程式为
的离子方程式为_______ 。
(2)装置A中g管的作用是_______ ;装置B中的试剂是_______ ;装置E中的试剂是_______ 。
(3)比较制取 和NaClO的反应条件,二者的差异是:
和NaClO的反应条件,二者的差异是:_______ 。
(4)写出制备NaClO反应的离子方程式_______ 。
(5)写出制备 的化学反应方程式
的化学反应方程式_______ 。
(6)若没有控制好反应温度,C中产物中可能有 、KClO和KCl三种盐生成,反应后
、KClO和KCl三种盐生成,反应后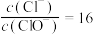 ,则溶液
,则溶液
_______ (填分数比)。
(7)碱石灰的成分是NaOH和CaO的混合物,盛放碱石灰的仪器m的名称是_______ ,其作用是(答出两条)_______ 。
 、NaClO和
、NaClO和 三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
三种物质。实验装置如下图所示,其中C的试管里盛有15mL 30% KOH溶液,并置于热水浴中;D的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;F中硬质玻璃管中为还原铁粉,FeCl3能吸收空气里的水分而潮解。回答下列问题:
(1)装置A中用
 和浓盐酸反应制备
和浓盐酸反应制备 的离子方程式为
的离子方程式为(2)装置A中g管的作用是
(3)比较制取
 和NaClO的反应条件,二者的差异是:
和NaClO的反应条件,二者的差异是:(4)写出制备NaClO反应的离子方程式
(5)写出制备
 的化学反应方程式
的化学反应方程式(6)若没有控制好反应温度,C中产物中可能有
 、KClO和KCl三种盐生成,反应后
、KClO和KCl三种盐生成,反应后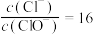 ,则溶液
,则溶液
(7)碱石灰的成分是NaOH和CaO的混合物,盛放碱石灰的仪器m的名称是
您最近一年使用:0次
解题方法
9 . 在化学活动周中,某校兴趣小组的同学在老师指导下探究铁元素相关物质的性质。回答下列问题:
(1)实验室现有一瓶 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式_______ 。为了证明制得的红褐色液体属于胶体,可以使用的方法是_______ ;乙同学将少量钠单质投入氯化铁溶液中制得铁单质,请评价这一实验方案的可行性_______ (若可行,请写出发生反应的离子方程式,若不可行,请说明理由)。
(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置 是实验室用草酸
是实验室用草酸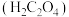 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
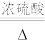
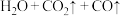 。
。
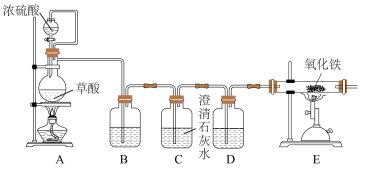
①装置B中盛放的药品为_______ ,装置D的作用为_______ 。
②在实验开始前,应先打开装置_______ (选填“A”或“E”)中的加热装置。写出装置 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移_______ ,其中氧化产物与还原产物的质量比为_______ 。
③该装置的主要缺陷是_______ 。
(1)实验室现有一瓶
 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置
 是实验室用草酸
是实验室用草酸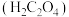 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
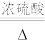
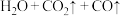 。
。
①装置B中盛放的药品为
②在实验开始前,应先打开装置
 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移③该装置的主要缺陷是
您最近一年使用:0次
解题方法
10 . 铈可用作优良的环保材料。现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备碳酸铈的工艺流程如下:___________ 。
(2)“酸浸”步骤中产生的气体为___________ (化学式)。
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是___________ (已知Ksp[Fe(OH)3]=8×10-38;Ksp[Ce(OH)3]=1×10-22;lg2=0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。
(4)“沉淀”步骤中发生反应的离子方程式为___________ 。
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为___________ 。
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;___________ 。
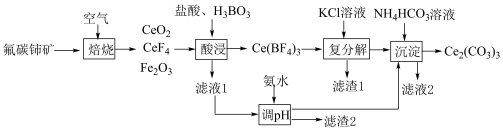
(2)“酸浸”步骤中产生的气体为
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是
(4)“沉淀”步骤中发生反应的离子方程式为
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;
您最近一年使用:0次



