名校
1 . 向体积为2L的恒容密闭容器中通入1.5molCH4(g)和1.5molH2O(g),发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如图。下列说法错误的是
CO(g)+3H2(g)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如图。下列说法错误的是

 CO(g)+3H2(g)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如图。下列说法错误的是
CO(g)+3H2(g)。在不同温度(Ta、Tb)下测得容器中n(CO)随时间的变化曲线如图。下列说法错误的是
| A.Ta>Tb |
| B.反应达到平衡时,每断裂4molC-H键,同时生成2molH-O键 |
| C.Tb时,CH4的平衡转化率是60% |
D.Ta时,平衡后体系的压强为起始压强的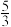 |
您最近一年使用:0次
2022-09-07更新
|
337次组卷
|
3卷引用:湖北省恩施州高中教育联盟2021-2022学年高二上学期期末考试化学试题
名校
解题方法
2 . NOx是形成雾霾天气的主要原因之一,以NOx为主的污染综合治理是当前重要的研究课题。
(1)汽车尾气中CO、NO2在一定条件下可以发生反应: 4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示:
4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示:

①0~10 min内该反应的平均速率v(CO)=_______ ,从11 min起其他条件不变,压缩容器的容积变为1 L。则:n(NO2)的变化曲线可能为图中的_______ (填字母)。
②恒温恒容条件下,不能说明该反应已达到平衡状态的是_______ (填字母)。
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象表示正确的是_______ (填序号)。

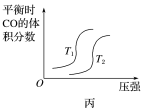
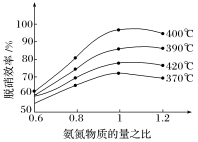
(2)用氨气催化氧化还原法脱硝(NOx)原理如下:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0。根据下图判断提高脱硝效率的最佳条件是
4N2(g)+6H2O(g) ΔH<0。根据下图判断提高脱硝效率的最佳条件是_______ ;氨氮比一定时,在400 ℃时,脱硝效率最大,其可能的原因是_______ 。
(1)汽车尾气中CO、NO2在一定条件下可以发生反应: 4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示:
4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示:
①0~10 min内该反应的平均速率v(CO)=
②恒温恒容条件下,不能说明该反应已达到平衡状态的是
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象表示正确的是


(2)用氨气催化氧化还原法脱硝(NOx)原理如下:4NO(g)+4NH3(g)+O2(g)
 4N2(g)+6H2O(g) ΔH<0。根据下图判断提高脱硝效率的最佳条件是
4N2(g)+6H2O(g) ΔH<0。根据下图判断提高脱硝效率的最佳条件是
您最近一年使用:0次
2022-09-06更新
|
235次组卷
|
4卷引用:福建省宁德市部分达标中学2021-2022学年高二上学期期中联合考试化学试题
3 . 有反应N2(g)+3H2(g)  2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
(1)在恒温恒压条件下进行,能判断反应处于平衡状态的是___________ ;
A.单位时间内生成1 mol N2,同时生成3 mol NH3
B.单位时间内生成3 mol H2,同时生成6 mol N-H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
E.容器中气体的平均分子质量不再随时间而改变
(2)一定温度下某恒容密闭容器中,充入3 mol H2和1 mol N2,2 min达到平衡状态时,总气体的物质的量变为原来0.9倍,则此时N2转化率为___________ ;若此时放出的热量为18.44 kJ,则其热化学方程式为___________ ;根据所求出的热化学方程式,且已知1 mol氮氮三键断裂需要945.8 kJ的能量,1 mol氢氢键断裂需要436 kJ的能量,求1 mol N-H键断裂吸收的能量___________ 。
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,则氨燃料电池的负极电极反应为___________ 。
 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,(1)在恒温恒压条件下进行,能判断反应处于平衡状态的是
A.单位时间内生成1 mol N2,同时生成3 mol NH3
B.单位时间内生成3 mol H2,同时生成6 mol N-H键
C.混合气体的密度不再随时间而改变
D.容器中气体的压强不再随时间而改变
E.容器中气体的平均分子质量不再随时间而改变
(2)一定温度下某恒容密闭容器中,充入3 mol H2和1 mol N2,2 min达到平衡状态时,总气体的物质的量变为原来0.9倍,则此时N2转化率为
(3)氨气可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,则氨燃料电池的负极电极反应为
您最近一年使用:0次
4 . Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_______
Ⅱ.甲醇是一种重要的可再生能源。
(2)已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a kJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ/mol
写出由CH4和O2制取甲醇的热化学方程式_______ 。
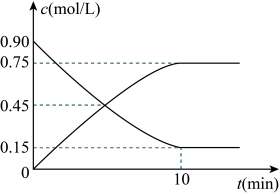
(3)通过下列反应制备甲醇:CO(g)+2H2(g) CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)_______ 。
(4)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示

①下列说法能判断该反应达到化学平衡状态的是_______ (填字母序号)。
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等 D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)_______ P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积为_______ L。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
Ⅱ.甲醇是一种重要的可再生能源。
(2)已知:2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=a kJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ/mol
写出由CH4和O2制取甲醇的热化学方程式
(3)通过下列反应制备甲醇:CO(g)+2H2(g)
 CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
CH3OH(g)。如图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化情况,从反应开始至到达平衡,用H2表示的反应速率v(H2)
(4)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示

①下列说法能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍 B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等 D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积为
您最近一年使用:0次
名校
5 . 在一定条件下,反应2A(g)+2B(g) 3C(g)+D(g),达到平衡状态的标志是:
3C(g)+D(g),达到平衡状态的标志是:
 3C(g)+D(g),达到平衡状态的标志是:
3C(g)+D(g),达到平衡状态的标志是:| A.单位时间内生成2nmolA,同时生成nmolD | B.容器内压强不随时间而变化 |
| C.单位时间内生成nmolB,同时消耗1.5nmolC | D.容器内混合气体密度不随时间而变化 |
您最近一年使用:0次
2022-09-01更新
|
1363次组卷
|
3卷引用:陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题
6 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为____ 。
(2)平衡后,若要提高H2的转化率,可以采取的措施有____ 。
(3)若在2L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1____ K2(填“<”、“>”或“=”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____ (填序号字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为____ 。若某时刻测得NH3、N2和H2物质的量均 为2mol时,则该时刻反应方向为:____ (填“正反应方向”、“逆反应方向”或“不”)移动。
(1)若在一个容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为(2)平衡后,若要提高H2的转化率,可以采取的措施有
| A.加了催化剂 | B.增大容器体积 | C.降低反应体系的温度 | D.加入一定量N2 |
 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
③400℃时,反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为
您最近一年使用:0次
2022-09-01更新
|
127次组卷
|
3卷引用:福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题
名校
7 . 将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)⇌2NH3(g)+CO2(g)。能判断该反应已达到化学平衡的是
①v(NH3)正=2v(CO2)逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器中n(NH3):n(CO2)=2:1
⑥混合气体总质量不变
①v(NH3)正=2v(CO2)逆
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器中n(NH3):n(CO2)=2:1
⑥混合气体总质量不变
| A.①②③⑥ | B.①②④⑥ | C.①③④⑤ | D.全部 |
您最近一年使用:0次
2022-09-01更新
|
946次组卷
|
8卷引用:辽宁省沈阳市铁西区重点协作校2021-2022学年高二上学期期中考试化学试题
解题方法
8 . 碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=________ kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述能表示该反应在恒温恒容条件下达到平衡状态的是________ 。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
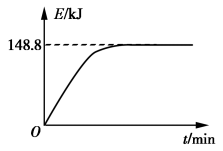
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为________ 。
(2)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2=2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________ mol·L1·min1。
(3)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为________ 。反应前后容器内气体压强之比为________ 。
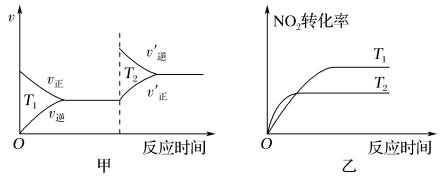
(4)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是________ (填代号)。
(1)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=
②CH4制备合成气的原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。A. 下列叙述能表示该反应在恒温恒容条件下达到平衡状态的是
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为

(2)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
| 序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
| Ⅰ | 0.10 | 0.10 | 0.414 |
| Ⅱ | 0.20 | 0.20 | 3.312 |
| Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2=2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=
(3)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为(4)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是

您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)CO2、CO是化石燃料燃烧后的主要产物,回收并利用CO2、CO是科学家研究的重要课题。CH4-CO2催化重整可以得到CO和H2:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH。
已知:C(s)+2H2(g)=CH4(g) ΔH1
C(s)+O2(g)=CO2(g) ΔH2
C(s)+ O2(g)=CO(g) ΔH3
O2(g)=CO(g) ΔH3
该催化重整反应的ΔH=_______ (用ΔH1、ΔH2和ΔH3表示)。
(2)利用回收的 制取甲醛的反应为CO2(g)+2H2(g)
制取甲醛的反应为CO2(g)+2H2(g) HCHO(g)+H2O(g)
HCHO(g)+H2O(g)  -6kJmol-1。一定条件下,将n(CO2):n(H2)=1:2的混合气体充入某恒温恒容的密闭容器中,下列描述能说明反应已达到平衡状态的是
-6kJmol-1。一定条件下,将n(CO2):n(H2)=1:2的混合气体充入某恒温恒容的密闭容器中,下列描述能说明反应已达到平衡状态的是_______ (填标号)。
a.单位时间内,断裂1mol的H-H键的,同时生成1mol的H-O键
b.H2O的体积分数保持不变
c.混合气体的平均相对分子质量不变
d.气体的密度不变
(3)ZnS是一种使用广泛的荧光材料。已知立方ZnS的晶胞结构如图所示:

①已知A、B点的原子坐标分别为(0,0,0)和(1, ,
, ),则C点的原子坐标为
),则C点的原子坐标为_______ ;
②立方ZnS的晶胞边长acm,则其晶体密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
(4)一种利用H2S电催化制氢并最终制得硫酸的装置如图所示:
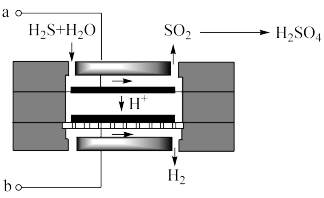
①阳极的电极反应式为_______ 。
②写出一个SO2经一步反应转化为H2SO4的化学方程式:_______ 。
(5)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______ 。( 为弱酸)
为弱酸)
(1)CO2、CO是化石燃料燃烧后的主要产物,回收并利用CO2、CO是科学家研究的重要课题。CH4-CO2催化重整可以得到CO和H2:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH。
已知:C(s)+2H2(g)=CH4(g) ΔH1
C(s)+O2(g)=CO2(g) ΔH2
C(s)+
 O2(g)=CO(g) ΔH3
O2(g)=CO(g) ΔH3该催化重整反应的ΔH=
(2)利用回收的
 制取甲醛的反应为CO2(g)+2H2(g)
制取甲醛的反应为CO2(g)+2H2(g) HCHO(g)+H2O(g)
HCHO(g)+H2O(g)  -6kJmol-1。一定条件下,将n(CO2):n(H2)=1:2的混合气体充入某恒温恒容的密闭容器中,下列描述能说明反应已达到平衡状态的是
-6kJmol-1。一定条件下,将n(CO2):n(H2)=1:2的混合气体充入某恒温恒容的密闭容器中,下列描述能说明反应已达到平衡状态的是a.单位时间内,断裂1mol的H-H键的,同时生成1mol的H-O键
b.H2O的体积分数保持不变
c.混合气体的平均相对分子质量不变
d.气体的密度不变
(3)ZnS是一种使用广泛的荧光材料。已知立方ZnS的晶胞结构如图所示:

①已知A、B点的原子坐标分别为(0,0,0)和(1,
 ,
, ),则C点的原子坐标为
),则C点的原子坐标为②立方ZnS的晶胞边长acm,则其晶体密度为
(4)一种利用H2S电催化制氢并最终制得硫酸的装置如图所示:

①阳极的电极反应式为
②写出一个SO2经一步反应转化为H2SO4的化学方程式:
(5)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式: 为弱酸)
为弱酸)
您最近一年使用:0次
10 . 用 生产某些含氯有机物时会产生副产物
生产某些含氯有机物时会产生副产物 。利用如下反应,可实现氯的循环利用:
。利用如下反应,可实现氯的循环利用: 
 。下列说法,
。下列说法,不正确 的是

 生产某些含氯有机物时会产生副产物
生产某些含氯有机物时会产生副产物 。利用如下反应,可实现氯的循环利用:
。利用如下反应,可实现氯的循环利用: 
 。下列说法,
。下列说法,
A.降低温度能提高 的平衡转化率 的平衡转化率 |
B.该反应的正反应活化能比逆反应活化能小 |
C.断裂 键和断裂 键和断裂 键的物质的量相等时,表明该反应处于平衡状态 键的物质的量相等时,表明该反应处于平衡状态 |
D.断裂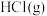 中 中  键比断裂 键比断裂 中 中  键所需的能量高 键所需的能量高 |
您最近一年使用:0次



