真题
1 . 常温下 水溶液体系中存在反应:
水溶液体系中存在反应: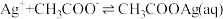 ,平衡常数为K。已初始浓度
,平衡常数为K。已初始浓度 ,所有含碳物种的摩尔分数与
,所有含碳物种的摩尔分数与 变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 水溶液体系中存在反应:
水溶液体系中存在反应: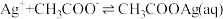 ,平衡常数为K。已初始浓度
,平衡常数为K。已初始浓度 ,所有含碳物种的摩尔分数与
,所有含碳物种的摩尔分数与 变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
变化关系如图所示(忽略溶液体积变化)。下列说法正确的是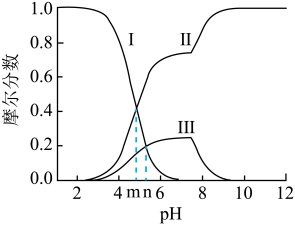
A.线Ⅱ表示 的变化情况 的变化情况 |
B. 的电离平衡常数 的电离平衡常数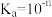 |
C. 时, 时,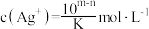 |
D.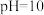 时, 时, |
您最近一年使用:0次
2 . 乙烯是一种用途广泛的有机化工原料。由乙烷制乙烯的研究备受关注。回答下列问题:
【乙烷制乙烯】
(1) 氧化脱氢反应:
氧化脱氢反应:
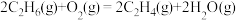
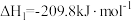
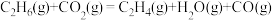
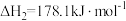
计算: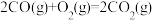

_______ 
(2) 直接脱氢反应为
直接脱氢反应为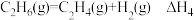 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则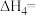
_______ 0(填“>”“<”或“=”)。结合下图。下列条件中,达到平衡时转化率最接近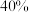 的是
的是_______ (填标号)。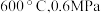 b.
b.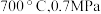 c.
c.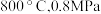
(3)一定温度和压强下、反应i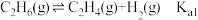
反应ⅱ (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)
①仅发生反应i时。 的平衡转化宰为
的平衡转化宰为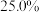 ,计算
,计算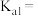
_______ 。
②同时发生反应i和ⅱ时。与仅发生反应i相比, 的平衡产率
的平衡产率_______ (填“增大”“减小”或“不变”)。
【乙烷和乙烯混合气的分离】
(4)通过 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的_______ 与 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是_______ 。
(5)常温常压下,将 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(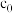 )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是_______ (填标号)。 ,两种气体均未被吸附
,两种气体均未被吸附
B.p点对应的时刻,出口气体的主要成分是
C.a-b对应的时间段内,吸附的 逐渐被
逐渐被 替代
替代
【乙烷制乙烯】
(1)
 氧化脱氢反应:
氧化脱氢反应: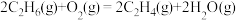
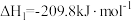
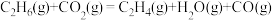
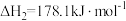
计算:
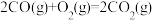


(2)
 直接脱氢反应为
直接脱氢反应为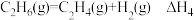 ,
, 的平衡转化率与温度和压强的关系如图所示,则
的平衡转化率与温度和压强的关系如图所示,则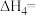
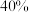 的是
的是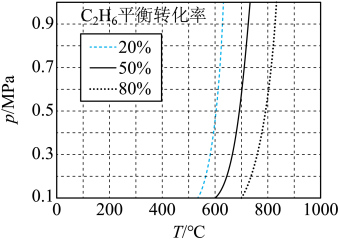
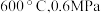 b.
b.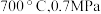 c.
c.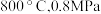
(3)一定温度和压强下、反应i
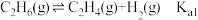
反应ⅱ
 (
( 远大于
远大于 )(
)( 是以平衡物质的量分数代替平衡浓度计算的平衡常数)
是以平衡物质的量分数代替平衡浓度计算的平衡常数)①仅发生反应i时。
 的平衡转化宰为
的平衡转化宰为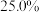 ,计算
,计算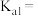
②同时发生反应i和ⅱ时。与仅发生反应i相比,
 的平衡产率
的平衡产率【乙烷和乙烯混合气的分离】
(4)通过
 修饰的Y分子筛的吸附-脱附。可实现
修饰的Y分子筛的吸附-脱附。可实现 和
和 混合气的分离。
混合气的分离。 的
的 分子的
分子的 键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离
键电子形成配位键,这种配位键强弱介于范德华力和共价键之间。用该分子筛分离 和
和 的优点是
的优点是(5)常温常压下,将
 和
和 等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(
等体积混合,以一定流速通过某吸附剂。测得两种气体出口浓度(c)与进口浓度(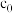 )之比随时间变化关系如图所示。下列推断合理的是
)之比随时间变化关系如图所示。下列推断合理的是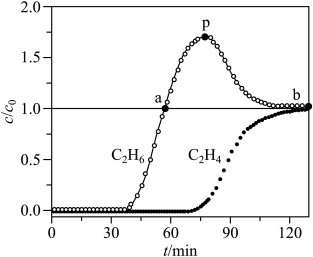
 ,两种气体均未被吸附
,两种气体均未被吸附B.p点对应的时刻,出口气体的主要成分是

C.a-b对应的时间段内,吸附的
 逐渐被
逐渐被 替代
替代
您最近一年使用:0次
名校
解题方法
3 . 电路板广泛用于计算机、手机等电子产品中。某兴趣小组拟制作带有“化学”标志的电路板并对废液进行回收利用。
I.制作电路板
小组同学取一小块覆铜板,用油性笔在铜板上写出“化学”标志,然后浸入 溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如图所示)。
溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如图所示)。_______ 。
(2)取少量废液于试管中,_______ (填操作和现象),则废液中含有 。
。
Ⅱ.回收废液
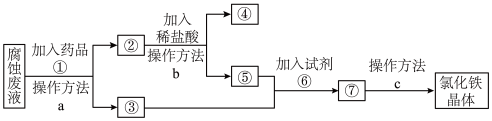
该组同学查阅资料:一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。
(3)废液100mL,加入铁粉,其固体质量的变化如图所示,假设溶液体积不变, 的物质的量
的物质的量_______ 。
② 点溶液中
点溶液中 的物质的量浓度
的物质的量浓度_______ 。
(4)操作方法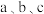 中是过滤的是
中是过滤的是_______ (填序号)。
(5)若取2mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,_______ (补全实验现象),此过程涉及氧化还原反应的化学方程式是:_______ 。
(6)试剂⑥是 时,发生反应的化学方程式是
时,发生反应的化学方程式是_______ 。
I.制作电路板
小组同学取一小块覆铜板,用油性笔在铜板上写出“化学”标志,然后浸入
 溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如图所示)。
溶液中,一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板和废液(如图所示)。
(2)取少量废液于试管中,
 。
。Ⅱ.回收废液
该组同学查阅资料:一种从腐蚀废液回收金属铜并获得氯化铁晶体的工艺流程如图。
(3)废液100mL,加入铁粉,其固体质量的变化如图所示,假设溶液体积不变,
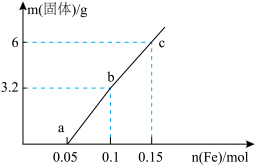
 的物质的量
的物质的量②
 点溶液中
点溶液中 的物质的量浓度
的物质的量浓度(4)操作方法
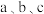 中是过滤的是
中是过滤的是(5)若取2mL溶液⑤加入试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(6)试剂⑥是
 时,发生反应的化学方程式是
时,发生反应的化学方程式是
您最近一年使用:0次
名校
4 . 最近,Schmidt及其同事开发了一种由Pd配合物催化的简单、高效合成螺环己二烯酮的方法,具体反应如右图(部分反应条件和产物省略)。下列说法错误是
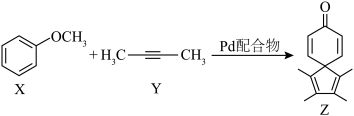
| A.X与对甲基苯酚互为同分异构体 |
| B.Z中σ键与π键的个数比为16:5 |
| C.Y与HBr加成最多得3种卤代烃(不考虑立体异构) |
| D.1molZ与足量氢气加成,最多消耗5mol氢气 |
您最近一年使用:0次
7日内更新
|
207次组卷
|
2卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
真题
解题方法
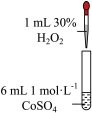
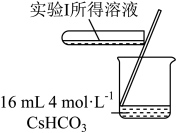
5 . 学习小组为探究 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。
已知: 为粉红色、
为粉红色、 为蓝色、
为蓝色、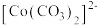 为红色、
为红色、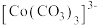 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:
(1)配制 的
的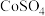 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的_______ (填标号)。
_______ (填“能”或“不能”)催化 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是_______ 。实验Ⅲ初步表明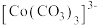 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式_______ 、_______ 。
(3)实验I表明,反应 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因_______ 。_______ 、_______ 。
 、
、 能否催化
能否催化 的分解及相关性质,室温下进行了实验I~Ⅳ。
的分解及相关性质,室温下进行了实验I~Ⅳ。| 实验I | 实验Ⅱ | 实验Ⅲ |
|
|
|
| 无明显变化 | 溶液变为红色,伴有气泡产生 | 溶液变为墨绿色,并持续产生能使带火星木条复燃的气体 |
 为粉红色、
为粉红色、 为蓝色、
为蓝色、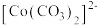 为红色、
为红色、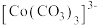 为墨绿色。回答下列问题:
为墨绿色。回答下列问题:(1)配制
 的
的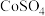 溶液,需要用到下列仪器中的
溶液,需要用到下列仪器中的a.  b.
b.  c.
c.  d.
d.

 的分解。实验Ⅱ中
的分解。实验Ⅱ中 大大过量的原因是
大大过量的原因是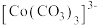 能催化
能催化 的分解,写出
的分解,写出 在实验Ⅲ中所发生反应的离子方程式
在实验Ⅲ中所发生反应的离子方程式(3)实验I表明,反应
 难以正向进行,利用化学平衡移动原理,分析
难以正向进行,利用化学平衡移动原理,分析 、
、 分别与
分别与 配位后,正向反应能够进行的原因
配位后,正向反应能够进行的原因实验Ⅳ:
您最近一年使用:0次
6 . 对金属材料中C、O、N、S的含量进行定性和定量分析,可以确定金属材料的等级。下列说法正确的是
| A.电离能大小:I1(N)>I1(O)>I1(S) | B.沸点高低:H2S>H2O>NH3 |
| C.酸性强弱:H2SO3>HNO3>H2CO3 | D.半径大小:r(S2-)>r(O2-)>r(N3-) |
您最近一年使用:0次
7 . 恒容密闭容器中充入X,在催化剂作用下发生反应: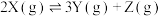 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
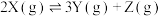 ,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是
,起始压强为p kPa,反应时间为t s,测得X的转化率随温度变化如图中实线所示,虚线表示X平衡转化率。下列说法正确的是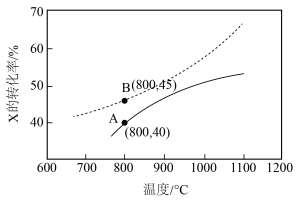
| A.该反应的ΔH<0 |
| B.催化剂可降低该反应的焓变,但不能提高平衡转化率 |
| C.通过延长反应时间,X的转化率能从A点交到B点 |
D.800℃时,A点物质X在0~t s内化学反应速率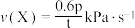 |
您最近一年使用:0次
8 . 下列比较中不正确的是
| A.键角:CH4>NH3>H2O |
| B.键的极性:N-H键<O-H键<F-H键 |
| C.酸性:CH2ClCOOH>CCl3COOH |
D.沸点: |
您最近一年使用:0次
真题
9 . 金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中MNPQ点的截面图,晶胞的边长为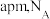 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
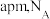 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是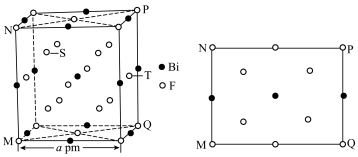
A.该铋氟化物的化学式为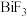 |
B.粒子S、T之间的距离为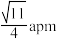 |
C.该晶体的密度为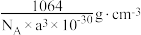 |
| D.晶体中与铋离子最近且等距的氟离子有6个 |
您最近一年使用:0次
10 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[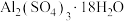 ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中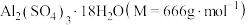 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中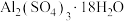 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[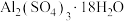 ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
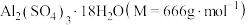 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
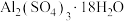 的质量分数是
的质量分数是
您最近一年使用:0次