名校
解题方法
1 . 设NA阿伏加德罗常数的值下列说法正确 的是
A.常温下,1mol硝酸铵溶于稀氨水使溶液呈中性,则NH 数目为NA 数目为NA |
| B.在过氧化钠与水的反应中,每生成0.1mol O2,转移电子的数目为0.4NA |
| C.1mol乙二酸(H2C2O4)分子中π键的数目为3NA |
| D.室温下,pH=12的Na2CO3溶液中,由水电离出的OH-数目为0.01NA |
您最近一年使用:0次
名校
2 . 某温度下,在2L密闭容器中投入一定量的A、B发生反应,12s时生成C的物质的量为0.8mol(过程如图)。

A.该反应的化学方程式为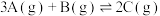 |
B.0~2s内用B表示的化学反应速率为0.1 |
| C.0~2s内平均反应速率大于4~6s内平均反应速率 |
| D.12s时容器内气体的总物质的量为起始时的9/13 |
您最近一年使用:0次
3 . 能源是制约国家发展进程的因素之一。二甲醚等被称为21世纪的绿色能源,工业上制备二甲醚原理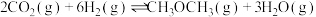 ,分别用Ir、Ce作催化剂,进行相同的时间后,测得的
,分别用Ir、Ce作催化剂,进行相同的时间后,测得的 的转化率
的转化率 随反应温度的变化情况如图所示。下列说法不正确的是
随反应温度的变化情况如图所示。下列说法不正确的是
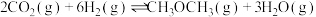 ,分别用Ir、Ce作催化剂,进行相同的时间后,测得的
,分别用Ir、Ce作催化剂,进行相同的时间后,测得的 的转化率
的转化率 随反应温度的变化情况如图所示。下列说法不正确的是
随反应温度的变化情况如图所示。下列说法不正确的是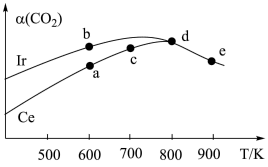
A.已知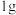 二甲醚气体完全燃烧生成稳定的氧化物放出的热量为 二甲醚气体完全燃烧生成稳定的氧化物放出的热量为 ,二甲醚燃烧热的热化学方程式 ,二甲醚燃烧热的热化学方程式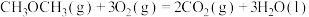 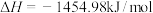 |
| B.二甲醚碱性燃料电池与乙醇碱性燃料电池,两种燃料所含共价键类型不同,断键时所需能量不同 |
C.反应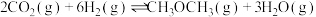 的 的 , ,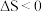 |
D.分别用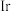 、 、 作催化剂时, 作催化剂时,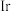 活化能降低更多 活化能降低更多 |
您最近一年使用:0次
名校
解题方法
4 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备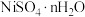 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。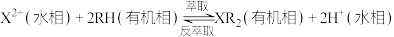 。
。
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有___________ (填元素符号)。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO___________ MgO(填“>”“<”或“=”),理由是___________ 。
(3)滤渣1的主要成分为___________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是___________ 。
(5)反萃取剂A为___________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为___________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:___________ ,该氧化物的化学式为___________ 。
②设 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备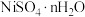 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。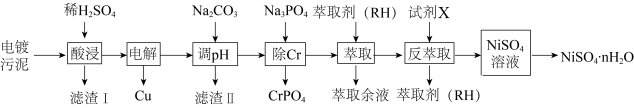
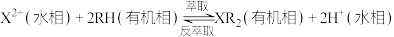 。
。回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(8)铁能形成多种氧化物,其中一种氧化物的晶胞结构如图所示:

②设
 表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为
表示阿伏加德罗常数的值,若该晶胞的参数为anm,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
真题
解题方法
5 . 市售的溴(纯度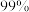 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓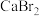 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为_______ ;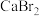 溶液的作用为
溶液的作用为_______ ;D中发生的主要反应的化学方程式为_______ 。_______ (填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为_______ 。
(3)利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为_______ 和_______ 。
(4)为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取_______ 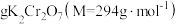 (用含m的代数式表示)。
(用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用_______ ,滤液沿烧杯壁流下。
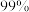 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓
 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为 溶液的作用为
溶液的作用为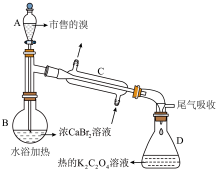
 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为(3)利用图示相同装置,将R和
 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为(4)为保证溴的纯度,步骤(3)中
 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取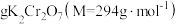 (用含m的代数式表示)。
(用含m的代数式表示)。(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用
您最近一年使用:0次
名校
6 . 冠醚是一种超分子,它是由多个二元醇分子之间脱水形成的环状化合物。18—冠—6可用作相转移催化其与 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是
 形成的螯合离子结构如图所示。下列说法正确的是
形成的螯合离子结构如图所示。下列说法正确的是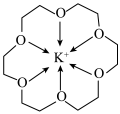
| A.该螯合离子形成的晶体类型为分子晶体 |
B.与二甲醚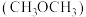 相比,该整合离子中“C-O-C”键角更大 相比,该整合离子中“C-O-C”键角更大 |
| C.该螯合离子中碳原子与氧原子杂化类型不同 |
| D.该螯合离子中所有非氢原子可以位于同一平面 |
您最近一年使用:0次
7 . X、Y、Z、W为原子序数依次增大的四种元素, 和
和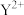 具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
 和
和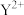 具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是
具有相同的电子构型,Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍,W最外层有一个未成对电子。下列说法正确的是| A.Z的最高价氧化物的熔点高于Y的最高价氧化物的熔点 |
| B.W和Y的氢化物所属的晶体类型分别为分子晶体和离子晶体 |
| C.基态X原子的核外电子有8种不同的空间运动状态 |
D.工业上常采用电解熔融化合物 的方式制备单质Y 的方式制备单质Y |
您最近一年使用:0次
名校
8 . 西沙群岛软珊瑚中存在多种朵蕾烷二萜类海洋天然产物,结构简式如图所示,具有较强抗菌、抗肿瘤等生物活性。下列关于该二萜类化合物的说法正确的是
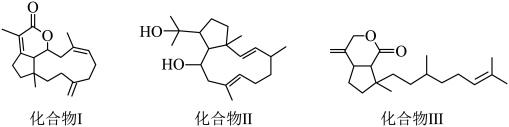
| A.化合物Ⅰ、Ⅱ、Ⅲ均属于芳香族化合物 |
B.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ最多消耗 的物质的量之比为3:2:2 的物质的量之比为3:2:2 |
| C.等物质的量的化合物Ⅰ、Ⅱ、Ⅲ中含有手性碳原子的个数比为1:3:2 |
| D.化合物Ⅱ、Ⅲ均能发生加成反应、氧化反应、取代反应和消去反应 |
您最近一年使用:0次
名校
9 . 肼( )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
(1)火箭发射可以用肼(液态)作燃料, 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。
已知: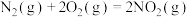
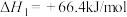
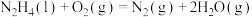
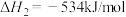
请写出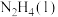 与
与 反应的热化学方程式
反应的热化学方程式______ 。
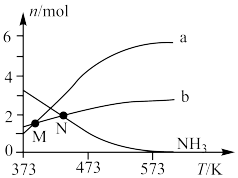
(2)向恒容密闭容器内加入一定量 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:
Ⅰ.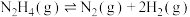
Ⅱ.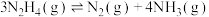
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:______ 。
②在较高温度肼几乎分解完全的原因可能是______ 。
③N点时,体系内 为
为______ 。
(3) 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:
①
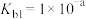 ;
;
②__________________________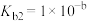 。
。
①写出 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:______ 。
②25℃时,向 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使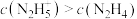 ,同时
,同时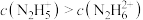 ,应控制溶液的
,应控制溶液的 范围为
范围为______ (用含a、b的式子表示)。
(4)利用 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示(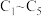 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。 电极反应式为
电极反应式为______ 。
②若甲装置 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少______ g。
 )是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
)是一种强还原性的高能物质,在航天、能源等领域有广泛应用。(1)火箭发射可以用肼(液态)作燃料,
 作氧化剂,两者反应生成
作氧化剂,两者反应生成 和水蒸气。
和水蒸气。已知:
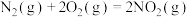
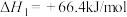
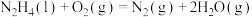
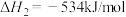
请写出
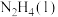 与
与 反应的热化学方程式
反应的热化学方程式(2)向恒容密闭容器内加入一定量
 ,一定条件下体系中存在以下平衡:
,一定条件下体系中存在以下平衡:Ⅰ.
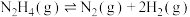
Ⅱ.
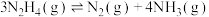
在较高温度肼几乎分解完全,分解产物的物质的量随温度变化如图:
②在较高温度肼几乎分解完全的原因可能是
③N点时,体系内
 为
为(3)
 是二元弱碱,
是二元弱碱, 在水溶液中存在如下两步电离:
在水溶液中存在如下两步电离:①

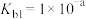 ;
;②__________________________
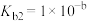 。
。①写出
 在水溶液中的第②步电离方程式:
在水溶液中的第②步电离方程式:②25℃时,向
 的水溶液中加入稀硫酸,欲使
的水溶液中加入稀硫酸,欲使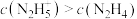 ,同时
,同时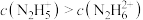 ,应控制溶液的
,应控制溶液的 范围为
范围为(4)利用
 燃料电池电解
燃料电池电解 溶液并制备
溶液并制备 ,装置如图所示(
,装置如图所示( 均为石墨电极,假设各装置在工作过程中溶液体积不变)。
均为石墨电极,假设各装置在工作过程中溶液体积不变)。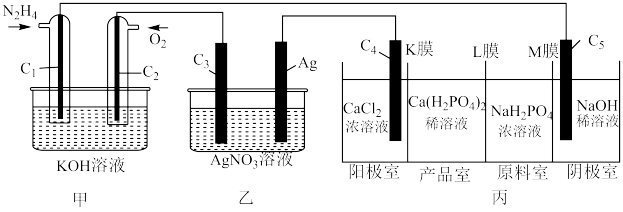
 电极反应式为
电极反应式为②若甲装置
 电极上消耗标准状况下1.12L的
电极上消耗标准状况下1.12L的 ,理论上丙装置阳极室溶液质量减少
,理论上丙装置阳极室溶液质量减少
您最近一年使用:0次
10 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。回答下列问题:
(1)冷敷袋在日常生活中具有保鲜、降温和镇痛等多种用途。常见冷敷袋所盛装的主要物质为 和
和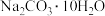 。
。
①写出 和
和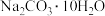 在一定条件下反应生成两种常见气体的化学方程式:
在一定条件下反应生成两种常见气体的化学方程式:______ 。
②该反应中反应物的总能量______ 生成物的总能量(填“大于”或“小于”)。
③某实验小组设计了如图甲中的三套实验装置,其中不能用来证明 和
和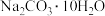 反应的能量变化情况的是
反应的能量变化情况的是______ (填序号)。 。
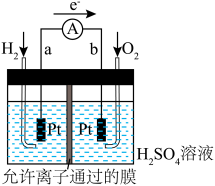
。______ (填“a”或“b”)极,电池工作时,溶液中 移向
移向______ (填“a”或“b”)极。
②若有4g 参加反应,则理论上
参加反应,则理论上 在b极获得电子的物质的量为
在b极获得电子的物质的量为______ 。
(3)已知合成氨反应: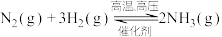 ,在—定温度下,向恒容的密闭容器中充入一定量的
,在—定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如下图所示。
发生反应,测得各组分浓度随时间变化如下图所示。
①表示c(H2)变化的曲线是______ (填“曲线A”、“曲线B”或“曲线C”)。
②下列描述一定能表示上述反应体系达平衡状态的是______ (填字母)。 ,同时生成2 mol的
,同时生成2 mol的
B. 的转化率不变
的转化率不变
C.容器内压强不再发生变化
D. 的百分含量不变
的百分含量不变
E.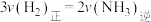
(4)已知: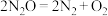 ,不同温度(T)下,恒容容器中
,不同温度(T)下,恒容容器中 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗—半时所需的相应时间),则
消耗—半时所需的相应时间),则
______ (填“>”“=”或“<”) 。当温度为
。当温度为 、起始压强为
、起始压强为 ,反应至
,反应至 min时,此时体系压强
min时,此时体系压强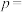
______ (用 表示)。
表示)。
(1)冷敷袋在日常生活中具有保鲜、降温和镇痛等多种用途。常见冷敷袋所盛装的主要物质为
 和
和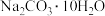 。
。①写出
 和
和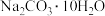 在一定条件下反应生成两种常见气体的化学方程式:
在一定条件下反应生成两种常见气体的化学方程式:②该反应中反应物的总能量
③某实验小组设计了如图甲中的三套实验装置,其中不能用来证明
 和
和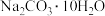 反应的能量变化情况的是
反应的能量变化情况的是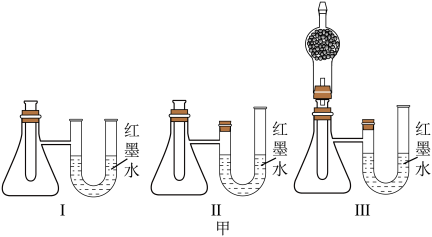
 。
。
 移向
移向②若有4g
 参加反应,则理论上
参加反应,则理论上 在b极获得电子的物质的量为
在b极获得电子的物质的量为(3)已知合成氨反应:
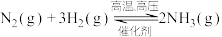 ,在—定温度下,向恒容的密闭容器中充入一定量的
,在—定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如下图所示。
发生反应,测得各组分浓度随时间变化如下图所示。①表示c(H2)变化的曲线是
②下列描述一定能表示上述反应体系达平衡状态的是
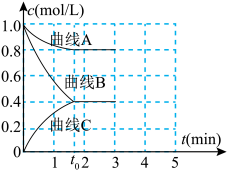
 ,同时生成2 mol的
,同时生成2 mol的
B.
 的转化率不变
的转化率不变C.容器内压强不再发生变化
D.
 的百分含量不变
的百分含量不变E.
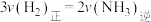
(4)已知:
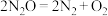 ,不同温度(T)下,恒容容器中
,不同温度(T)下,恒容容器中 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗—半时所需的相应时间),则
消耗—半时所需的相应时间),则
 。当温度为
。当温度为 、起始压强为
、起始压强为 ,反应至
,反应至 min时,此时体系压强
min时,此时体系压强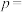
 表示)。
表示)。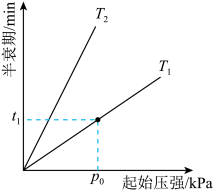
您最近一年使用:0次



