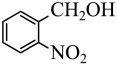
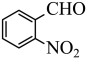
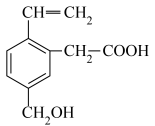
1 . 某有机物的结构简式如图所示,则下列说法中不正确的是
A.该有机物既能与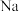 反应,还能与 反应,还能与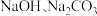 反应 反应 |
| B.该有机物中有3种官能团 |
| C.该有机物在一定条件下能发生加成、加聚、取代、氧化等反应 |
D. 该有机物和足量金属钠反应生成 该有机物和足量金属钠反应生成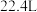 气体 气体 |
您最近一年使用:0次
名校
2 . 硫元素广泛存在于自然界中,是动植物生长不可缺少的元素。
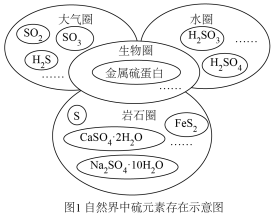
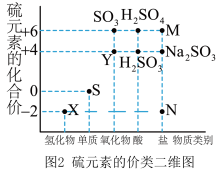
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
II.小组同学利用图3装置测定空气中 的含量。
的含量。___________ ,该装置中发生反应的离子方程式为___________ 。
(5)若空气流速为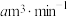 ,当观察到装置内
,当观察到装置内___________ 时,结束计时,测定耗时tmin,假定空气中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是II.小组同学利用图3装置测定空气中
 的含量。
的含量。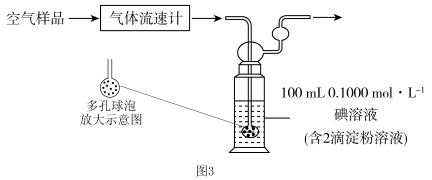
(5)若空气流速为
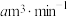 ,当观察到装置内
,当观察到装置内 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
3 . 甲酸铵是一种常见分析试剂,常用于制药、电解、电容器等行业。25℃时,用HCl气体或NaOH固体改变0.1mol/L的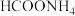 溶液的pH,
溶液的pH,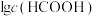 、
、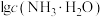 、
、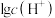 和
和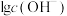 随pH变化的关系如图所示(已知:
随pH变化的关系如图所示(已知: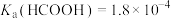 ,
,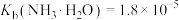 ]。下列说法错误的是
]。下列说法错误的是
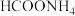 溶液的pH,
溶液的pH,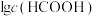 、
、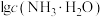 、
、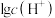 和
和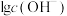 随pH变化的关系如图所示(已知:
随pH变化的关系如图所示(已知: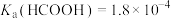 ,
,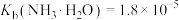 ]。下列说法错误的是
]。下列说法错误的是
A.0.1mol/L的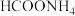 溶液中, 溶液中,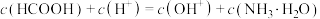 |
B.P点溶液存在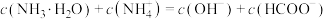 |
C.O点对应溶液中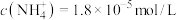 |
| D.Q点溶液pH=6.5 |
您最近一年使用:0次
解题方法
4 . 某废水处理过程中始终保持 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与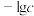 关系如下图所示,c为
关系如下图所示,c为 、
、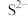 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: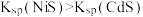 。下列说法正确的是
。下列说法正确的是
 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与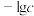 关系如下图所示,c为
关系如下图所示,c为 、
、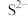 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知:
。已知: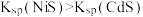 。下列说法正确的是
。下列说法正确的是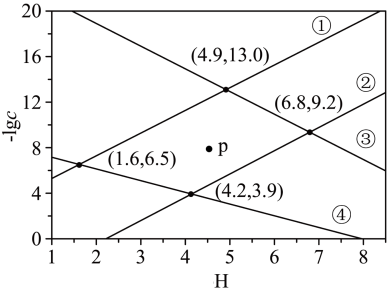
A.④为pH与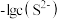 的关系曲线 的关系曲线 |
B.p点生成的沉淀中含有 和 和 |
C. 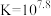 |
D.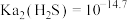 |
您最近一年使用:0次
名校
5 . 硼、氮、铁、钴、镍等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
(2)硼酸( )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在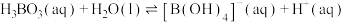 的平衡,回答下列问题。
的平衡,回答下列问题。__________ 。
②下列关于硼酸的说法正确的是__________ (填序号)。
a. 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
c.硼酸分子的稳定性与氢键有关 d. 晶体中有
晶体中有 氢键
氢键
(3)叠氮化合物在化工上有重要应用, 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式__________ (写出一种即可),其立体构型为__________ 。
(4) 的结构如图所示,
的结构如图所示, 中
中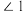 、
、 、
、 由大到小的顺序是
由大到小的顺序是____________________ 。 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于__________ 位置。
①从该晶胞中能分割出来的结构图有_______ (填标号)。 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有__________ 个,该距离为__________ pm(仅列式不计算)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是______(填标号)。
A.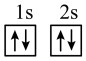 | B. |
C.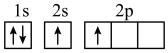 | D.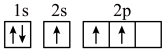 |
(2)硼酸(
 )为片层状白色晶体,层内
)为片层状白色晶体,层内 分子间通过氢键相连,如图所示。
分子间通过氢键相连,如图所示。 水溶液中存在
水溶液中存在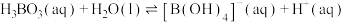 的平衡,回答下列问题。
的平衡,回答下列问题。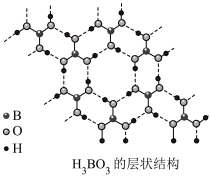
②下列关于硼酸的说法正确的是
a.
 是一元酸 b.硼酸水溶液中水的电离平衡受到抑制
是一元酸 b.硼酸水溶液中水的电离平衡受到抑制c.硼酸分子的稳定性与氢键有关 d.
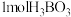 晶体中有
晶体中有 氢键
氢键(3)叠氮化合物在化工上有重要应用,
 为叠氮离子,写出与
为叠氮离子,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式(4)
 的结构如图所示,
的结构如图所示, 中
中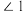 、
、 、
、 由大到小的顺序是
由大到小的顺序是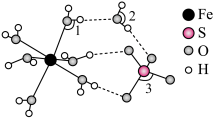
 )晶胞沿
)晶胞沿 、
、 或
或 轴任意一个方向的投影如下图所示。晶胞中
轴任意一个方向的投影如下图所示。晶胞中 处于各顶角位置,则O处于
处于各顶角位置,则O处于
①从该晶胞中能分割出来的结构图有
a.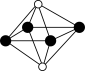 b.
b.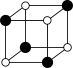 c.
c.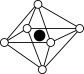 d.
d. e.
e.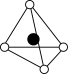
 ,
, 为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
为阿伏加德罗常数的值。该晶胞中镍离子周围与其等距离且最近的镍离子有
您最近一年使用:0次
名校
解题方法
6 . 在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则

___________  。
。
(2)①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
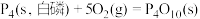
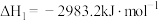
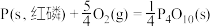
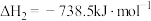
则该温度下白磷转化为红磷的热化学方程式为___________ 。相同状况下,能量较低的是___________ (填“红磷”或“白磷”),白磷的稳定性比红___________ (填“高”或“低”)。
(3)已知:①

②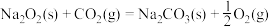
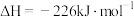
则 与
与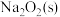 反应放出509kJ热量时,电子转移数目为
反应放出509kJ热量时,电子转移数目为___________ 。
(4)已知
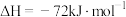 ,蒸发1mol
,蒸发1mol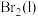 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:
则表中
___________ 。
(5)在容积为2L的恒温密闭容器中,充入1mol 和3mol
和3mol 一定条件下发生反应:
一定条件下发生反应: 能说明上述反应达到平衡状态的是___________(填字母)
能说明上述反应达到平衡状态的是___________(填字母)
(6)将燃煤产生的二氧化碳回收利用,可做到低碳排放。如图是通过人工光合作用以 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为
的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为___________ 。
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则


 。
。(2)①已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
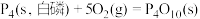
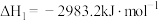
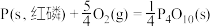
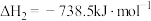
则该温度下白磷转化为红磷的热化学方程式为
(3)已知:①


②
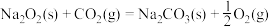
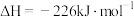
则
 与
与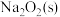 反应放出509kJ热量时,电子转移数目为
反应放出509kJ热量时,电子转移数目为(4)已知

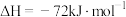 ,蒸发1mol
,蒸发1mol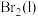 需要吸收的能量为30kJ,其他相关数据如下表:
需要吸收的能量为30kJ,其他相关数据如下表:| 物质 |  | 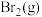 | 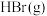 |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |

(5)在容积为2L的恒温密闭容器中,充入1mol
 和3mol
和3mol 一定条件下发生反应:
一定条件下发生反应: 能说明上述反应达到平衡状态的是___________(填字母)
能说明上述反应达到平衡状态的是___________(填字母)A.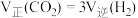 |
| B.混合气体的密度不随时间的变化而变化 |
C.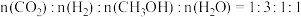 |
| D.混合气体的平均摩尔质量不随时间的变化而变化 |
(6)将燃煤产生的二氧化碳回收利用,可做到低碳排放。如图是通过人工光合作用以
 和
和 为原料制备HCOOH和
为原料制备HCOOH和 的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为
的原理示意图,电极a、b表面发生电极反应,其中b电极反应式为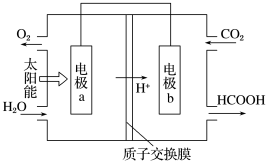
您最近一年使用:0次
名校
7 . 探究 与
与 对
对 分解的催化效率。
分解的催化效率。
(1)甲同学进行了如下的实验。
在两支试管中分别加入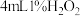 溶液,然后各滴加5滴
溶液,然后各滴加5滴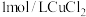 溶液和5滴
溶液和5滴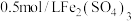 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论: 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
①乙认为甲方案不合理的理由有___________ (填选项符号)。
a. 溶液和
溶液和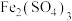 溶液的浓度不同
溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c. 溶液浓度过低
溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:___________ 。
③根据实验结果,乙得出是结论是:___________ 。
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的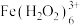 :
: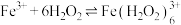 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:___________ 。
(3)乙同学在翻阅资料时还发现 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入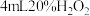 溶液,滴加几滴
溶液,滴加几滴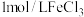 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入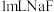 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是___________ (填选项符号)。
a. 对
对 的分解几乎无催化作用
的分解几乎无催化作用
b.温度相同时,含相同浓度的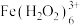 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大
c.颜色由棕褐色褪为无色时反应的离子方程式是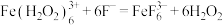
 与
与 对
对 分解的催化效率。
分解的催化效率。(1)甲同学进行了如下的实验。
在两支试管中分别加入
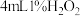 溶液,然后各滴加5滴
溶液,然后各滴加5滴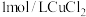 溶液和5滴
溶液和5滴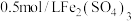 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。甲由此得出了结论:
 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。乙同学认为甲的方案不太合理,做了如下的改进:
| 试管1 | 试管2 | |
| 实验 | 在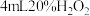 溶液中滴加5滴 溶液中滴加5滴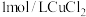 溶液 溶液 | 在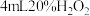 溶液中滴加5滴 溶液中滴加5滴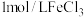 溶液 溶液 |
| 现象 | ⅰ.加入溶液后,产生气泡 ⅱ.生成气泡速率先加快后又减慢 ⅲ.整个过程中溶液始终保持浅蓝色。 ⅳ.且整个过程中产生气泡的速率低于试管2中。 | ⅰ.加入溶液后,试管内液体立即变为棕褐色,并产生气泡 ⅱ.生成气泡速率先加快后又减慢。 ⅲ.溶液棕褐色逐渐变浅,反应结束时变为浅黄色。 |
a.
 溶液和
溶液和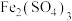 溶液的浓度不同
溶液的浓度不同b.两种催化剂溶液中的阴离子不同
c.
 溶液浓度过低
溶液浓度过低②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为
 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的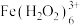 :
: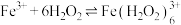 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:(3)乙同学在翻阅资料时还发现
 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入
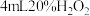 溶液,滴加几滴
溶液,滴加几滴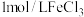 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入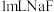 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。由此判断,下列说法正确的是
a.
 对
对 的分解几乎无催化作用
的分解几乎无催化作用b.温度相同时,含相同浓度的
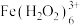 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大c.颜色由棕褐色褪为无色时反应的离子方程式是
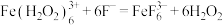
您最近一年使用:0次
名校
8 . 合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙( )与水蒸气反应制备氨:
)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙( );
);
ⅱ.氰氨化钙与水蒸气反应生成氨气。写出反应ⅱ的化学方程式:___________ 。
(2)20世纪初,以 和
和 为原料的工业合成氨方法研制成功。其反应为:
为原料的工业合成氨方法研制成功。其反应为:
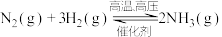

①写出氮气的电子式___________ 。
② 的化学性质稳定,即使在高温、高压下,
的化学性质稳定,即使在高温、高压下, 和
和 的化合反应仍然进行得十分缓慢。从结构角度解释原因:
的化合反应仍然进行得十分缓慢。从结构角度解释原因:___________ 。
③压强对合成氨有较大影响。下图为不同压强下,以物质的量分数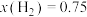 、
、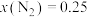 进料(组成1),反应达平衡时
进料(组成1),反应达平衡时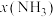 与温度的计算结果。
与温度的计算结果。
___________  (填“>”或“<”),简述理由:
(填“>”或“<”),简述理由:___________ 。
ⅱ.在 、
、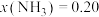 时,氮气的转化率为
时,氮气的转化率为___________ 。
(3)我国科学家研制出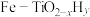 双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而
双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而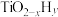 的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。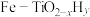 双催化剂双温催化合成氨具备优势的原因是
双催化剂双温催化合成氨具备优势的原因是___________ 。
(1)1898年,化学家用氮气、碳化钙(
 )与水蒸气反应制备氨:
)与水蒸气反应制备氨:ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(
 );
);ⅱ.氰氨化钙与水蒸气反应生成氨气。写出反应ⅱ的化学方程式:
(2)20世纪初,以
 和
和 为原料的工业合成氨方法研制成功。其反应为:
为原料的工业合成氨方法研制成功。其反应为: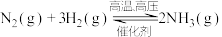

①写出氮气的电子式
②
 的化学性质稳定,即使在高温、高压下,
的化学性质稳定,即使在高温、高压下, 和
和 的化合反应仍然进行得十分缓慢。从结构角度解释原因:
的化合反应仍然进行得十分缓慢。从结构角度解释原因:③压强对合成氨有较大影响。下图为不同压强下,以物质的量分数
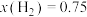 、
、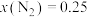 进料(组成1),反应达平衡时
进料(组成1),反应达平衡时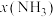 与温度的计算结果。
与温度的计算结果。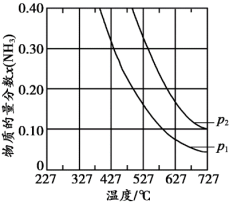

 (填“>”或“<”),简述理由:
(填“>”或“<”),简述理由:ⅱ.在
 、
、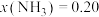 时,氮气的转化率为
时,氮气的转化率为(3)我国科学家研制出
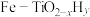 双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而
双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而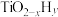 的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。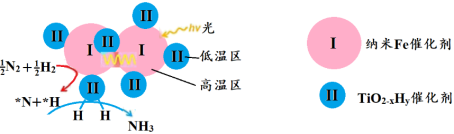
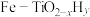 双催化剂双温催化合成氨具备优势的原因是
双催化剂双温催化合成氨具备优势的原因是
您最近一年使用:0次
名校
解题方法
9 . 氨气在工农业生产中有重要应用。
(1)①写出实验室制氨气的化学方程式:___________ 。
② 的稳定性比
的稳定性比
___________ (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。___________ 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是___________ (写化学式,一种即可)。
③ 液滴中先出现白色沉淀,写出离子反应方程式
液滴中先出现白色沉淀,写出离子反应方程式___________ 。白色沉淀迅速变成灰绿色沉淀,过一段时间后变成红褐色,写出化学反应方程式___________ 。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),反应的化学方程式为
),反应的化学方程式为___________ ,若反应中有0.3mol电子发生转移时,生成亚硝酸的质量为___________ g(小数点后保留两位有效数字)。
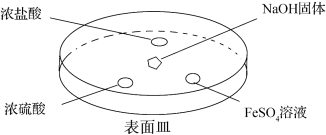
(4) 可以转化为其他含氮物质,下面为
可以转化为其他含氮物质,下面为 转化为
转化为 的流程。
的流程。
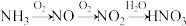
①写出 与
与 反应转化为NO的化学方程式
反应转化为NO的化学方程式___________ 。
② 转化为
转化为 的整个过程中,为提高氮原子的利用率,可采取的措施是
的整个过程中,为提高氮原子的利用率,可采取的措施是___________ 。
(1)①写出实验室制氨气的化学方程式:
②
 的稳定性比
的稳定性比
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③
 液滴中先出现白色沉淀,写出离子反应方程式
液滴中先出现白色沉淀,写出离子反应方程式(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),反应的化学方程式为
),反应的化学方程式为(4)
 可以转化为其他含氮物质,下面为
可以转化为其他含氮物质,下面为 转化为
转化为 的流程。
的流程。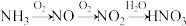
①写出
 与
与 反应转化为NO的化学方程式
反应转化为NO的化学方程式②
 转化为
转化为 的整个过程中,为提高氮原子的利用率,可采取的措施是
的整个过程中,为提高氮原子的利用率,可采取的措施是
您最近一年使用:0次
名校
解题方法
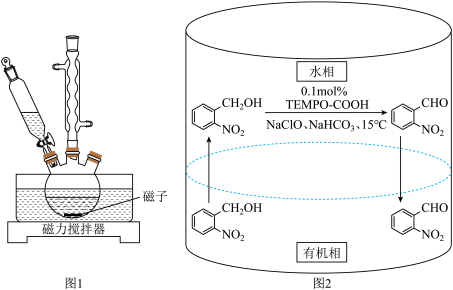
10 . 实验室以邻硝基苄醇为原料,通过图1装置(夹持仪器已略去)利用两相反应体系(图2)在TEMPO-COOH水溶液做催化剂下实现选择性氧化合成邻硝基苯甲醛。部分物质的性质如下表所示。
Ⅱ.反应完全后,将反应液倒入分液漏斗,分出有机层后,水相用10.0mL二氯甲烷萃取,合并有机相,经无水硫酸钠干燥、过滤后,除去并回收滤液中的二氯甲烷,得到粗品。
Ⅲ.将粗品溶解在20.0mL二氯甲烷中,加入10.0mL饱和NaHSO3溶液,充分作用后,分离得到水层,水层在冰浴中用5%氢氧化钠溶液调节pH到10,浅黄色固体析出完全。抽滤、干燥至恒重,得1.30g产品。
(1)控制反应温度为15℃的方法是___________ ;滴加NaC1O溶液时,需要先将漏斗上端玻璃塞打开,目的是___________ 。
(2)合成产品的化学方程式为___________ 。
(3)配制饱和NaHCO3溶液时,必须使用的仪器是(填写仪器名称)___________ 。____________ ,该副产物主要成分是___________ 。
(5)步骤Ⅱ中除去并回收二氯甲烷的实验方法是___________ 。
(6)本实验产率为___________ (计算结果保留3位有效数字)。
| 物质 |
|
| TEMPO-COOH |
| 溶解性 | 微溶于水,易溶于CH2Cl2 | 难溶于水,易溶于CH2Cl2 | 易溶于水,难溶于CH2Cl2 |
| 熔点/℃ | 70 | 43 | —— |
| 沸点/℃ | 270 | 153 | —— |
已知: 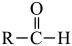 +NaHSO3
+NaHSO3
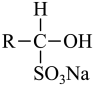 (易溶于水);
(易溶于水);
Ⅱ.反应完全后,将反应液倒入分液漏斗,分出有机层后,水相用10.0mL二氯甲烷萃取,合并有机相,经无水硫酸钠干燥、过滤后,除去并回收滤液中的二氯甲烷,得到粗品。
Ⅲ.将粗品溶解在20.0mL二氯甲烷中,加入10.0mL饱和NaHSO3溶液,充分作用后,分离得到水层,水层在冰浴中用5%氢氧化钠溶液调节pH到10,浅黄色固体析出完全。抽滤、干燥至恒重,得1.30g产品。
(1)控制反应温度为15℃的方法是
(2)合成产品的化学方程式为
(3)配制饱和NaHCO3溶液时,必须使用的仪器是(填写仪器名称)
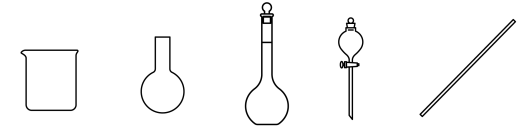
(5)步骤Ⅱ中除去并回收二氯甲烷的实验方法是
(6)本实验产率为
您最近一年使用:0次