1 . 亚氯酸钠 是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
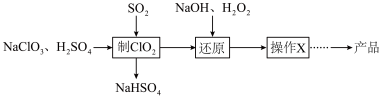
已知:“操作X”为蒸发浓缩、冷却结晶。下列说法正确的是
 是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
是一种高效的漂白剂和氧化剂。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
已知:“操作X”为蒸发浓缩、冷却结晶。下列说法正确的是
A.“制 ”中氧化剂与还原剂物质的量之比为 ”中氧化剂与还原剂物质的量之比为 |
B.“还原”发生反应的离子方程式为 |
| C.“操作X”需要用到的仪器为坩埚、酒精灯、玻璃棒 |
D. 作氧化剂时,转移电子的物质的量约为同质量 作氧化剂时,转移电子的物质的量约为同质量 的1.57倍 的1.57倍 |
您最近半年使用:0次
名校
2 . 某工厂废液中含有大量的 、
、 及少量的
及少量的 、
、 ,利用该废液制备
,利用该废液制备 的流程如下:
的流程如下:
称取m g产品溶解于大量较浓盐酸中,在 氛围下用适量还原剂恰好将
氛围下用适量还原剂恰好将 还原为
还原为 ,用
,用 的
的 标准液滴定,终点时消耗标准液V mL。
标准液滴定,终点时消耗标准液V mL。
已知:①氧化性 ;
;
②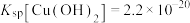 ,
,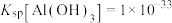 ;
;
③当溶液中离子浓度小于等于 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。
根据上述产品含量测定的实验原理,下列说法错误的是
 、
、 及少量的
及少量的 、
、 ,利用该废液制备
,利用该废液制备 的流程如下:
的流程如下: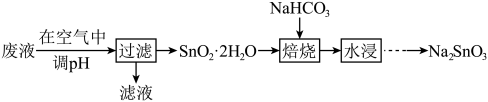
称取m g产品溶解于大量较浓盐酸中,在
 氛围下用适量还原剂恰好将
氛围下用适量还原剂恰好将 还原为
还原为 ,用
,用 的
的 标准液滴定,终点时消耗标准液V mL。
标准液滴定,终点时消耗标准液V mL。已知:①氧化性
 ;
;②
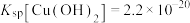 ,
,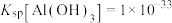 ;
;③当溶液中离子浓度小于等于
 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。根据上述产品含量测定的实验原理,下列说法错误的是
A.实验室配制 溶液时需加入盐酸和锡粉 溶液时需加入盐酸和锡粉 |
| B.若加入的还原剂不足,则测定结果偏小 |
C.滴定时选用淀粉作指示剂,产生 的离子方程式: 的离子方程式: |
D.则产品中Sn的质量分数为 % % |
您最近半年使用:0次
3 . 2023年化学诺贝尔奖授予三位科学家以表彰他们发现和合成量子点方面做出的贡献.我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)氮化碳( )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是
 )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是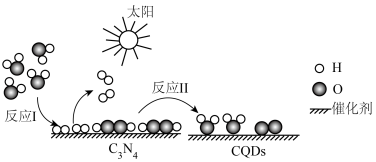
A.反应Ⅰ的化学方程式为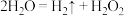 |
| B.该过程涉及太阳能、热能及化学能之间的转化 |
C.该过程实现高效分解水的同时也产生副产物 |
D.若 ,则 ,则 与 与 的大小关系为 的大小关系为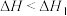 |
您最近半年使用:0次
4 . 我国力争实现2030年前“碳达峰”、2060年前“碳中和”的目标,二氧化碳的捕捉与封存是目标实现的重要途径。回答下列问题:
I.常温下,某同学用 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
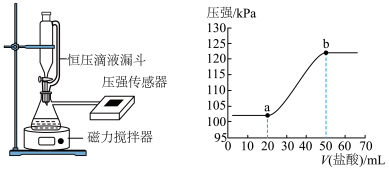
(1) 段反应的离子方程式为
段反应的离子方程式为___________ 。
(2)所得溶液的溶质成分为___________ (填化学式), 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
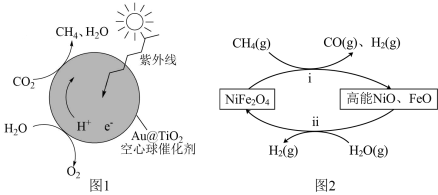
(3)图1中 为
为___________ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”),空心球催化过程的总反应方程式为___________ 。
(4)图2第i步反应转移 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为___________  ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则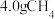 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为___________  。
。
I.常温下,某同学用
 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
(1)
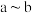 段反应的离子方程式为
段反应的离子方程式为(2)所得溶液的溶质成分为
 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中
 为
为(4)图2第i步反应转移
 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为 ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则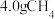 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为 。
。
您最近半年使用:0次
解题方法
5 .  是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
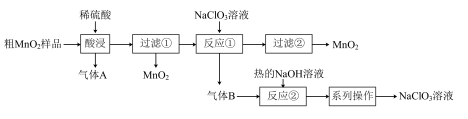
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
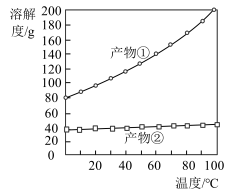
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
(4)若粗 样品的质量为
样品的质量为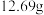 ,经“过滤①”得到
,经“过滤①”得到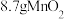 ,并收集到
,并收集到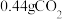 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为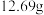 ,经“过滤①”得到
,经“过滤①”得到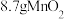 ,并收集到
,并收集到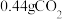 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近半年使用:0次
解题方法
6 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
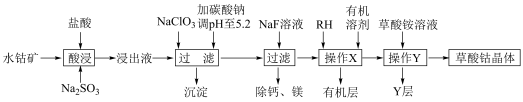
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液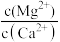 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
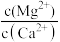 =
=
您最近半年使用:0次
解题方法
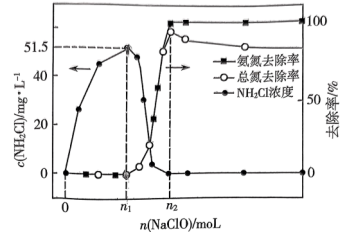
7 . 工业上可用次氯酸盐将氨氮废水转化为 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①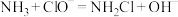
②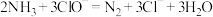
③
已知: 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是
 实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的
实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的 混合(混合溶液体积为
混合(混合溶液体积为 ),测得溶液中氨氮(氨、
),测得溶液中氨氮(氨、 )和总氮(氨氮和
)和总氮(氨氮和 的总和)的去除率及
的总和)的去除率及 的浓度与
的浓度与 的加入量关系如图所示。
的加入量关系如图所示。
在此过程中发生的反应为:
①
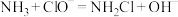
②
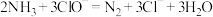
③

已知:
 中氮元素为
中氮元素为 价。下列说法正确的是
价。下列说法正确的是A.当 时,反应①中转移电子的物质的量为 时,反应①中转移电子的物质的量为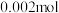 |
B.当 时, 时, |
C. |
D.当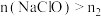 时, 时,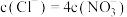 |
您最近半年使用:0次
解题方法
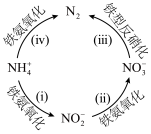
8 . 一种利用 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
 和
和 进行新型脱氮的过程如下图所示。下列说法正确的是
进行新型脱氮的过程如下图所示。下列说法正确的是
A.铁氨氧化中, 转化为 转化为 |
B.将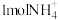 转化为 转化为 ,两个途径最终失去的电子数相同 ,两个途径最终失去的电子数相同 |
C.反应iii的离子方程式为 |
| D.四步反应中,氮元素均被氧化 |
您最近半年使用:0次
解题方法
9 . 三氧化二镍( )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。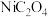 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。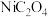 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近半年使用:0次
名校
解题方法
10 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“ ,
, 、
、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:
(1)根据汞的原子结构示意图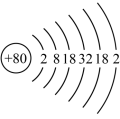 判断,汞在第
判断,汞在第___________ 周期。工业上冶炼金属汞的方法为___________ 。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是___________ 。
A.硒元素的最低负化合价为 价
价
B.还原性: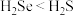
C.二氧化硒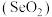 具有还原性
具有还原性
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是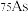 ,它的中子数为
,它的中子数为___________ 。
②已知 与
与 的性质相似,则对
的性质相似,则对 性质的推测正确的是
性质的推测正确的是___________ 。
A.含有离子键和共价键
B.能与 溶液反应
溶液反应
C.加热充分分解时与 分解产物的种类完全一样
分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法正确的是___________ 。
A.热稳定性:
B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸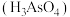 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为___________ 。
 ,
, 、
、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:(1)根据汞的原子结构示意图
 判断,汞在第
判断,汞在第(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是
A.硒元素的最低负化合价为
 价
价B.还原性:
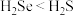
C.二氧化硒
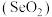 具有还原性
具有还原性(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是
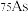 ,它的中子数为
,它的中子数为②已知
 与
与 的性质相似,则对
的性质相似,则对 性质的推测正确的是
性质的推测正确的是A.含有离子键和共价键
B.能与
 溶液反应
溶液反应C.加热充分分解时与
 分解产物的种类完全一样
分解产物的种类完全一样③下列关于第ⅤA族元素及其化合物的说法正确的是
A.热稳定性:

B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸
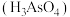 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为
您最近半年使用:0次
2024-02-11更新
|
126次组卷
|
3卷引用:山东省东明县第一中学2023-2024学年高一下学期4月第一次月考化学试题




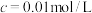 )的
)的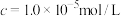 )的
)的

