名校
1 .  是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物
Ⅱ.0.1
 溶液的pH=1.0
溶液的pH=1.0
Ⅲ.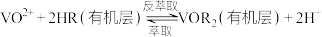
回答下列问题:
(1)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知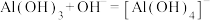
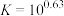 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)
(2)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
(3)反萃取剂应选用___________ (填“酸性”、“中性”或“碱性”)溶液;若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(4)生成 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入NaOH维持最佳pH,若 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是___________ 。
 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: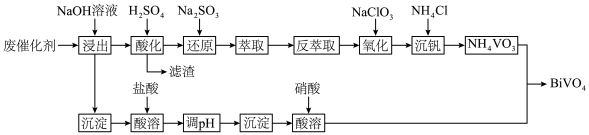
 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物Ⅱ.0.1

 溶液的pH=1.0
溶液的pH=1.0Ⅲ.
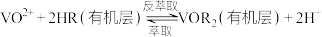
回答下列问题:
(1)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为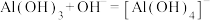
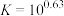 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)(2)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(3)反萃取剂应选用
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(4)生成
 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: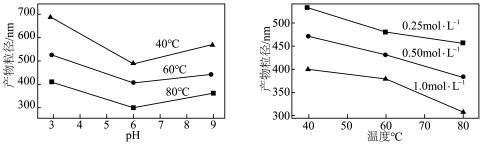
 晶体的最佳条件是
晶体的最佳条件是 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是
您最近半年使用:0次
2024-03-14更新
|
976次组卷
|
5卷引用:山东省烟台市2024届高三一模化学试题
名校
2 . 大连理工大学课题组通过CuO/ 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,1.12L NO中含有电子数为1.5 |
B.将 个 个 溶于100mL水中,所得溶液的质量分数约为29.9% 溶于100mL水中,所得溶液的质量分数约为29.9% |
C.生成22g  能消除NO的数目为0.2 能消除NO的数目为0.2 |
D.若NO和CO混合气体的平均相对分子质量为29,则含有CO的数目为0.5 |
您最近半年使用:0次
2024-03-13更新
|
274次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
解题方法
3 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
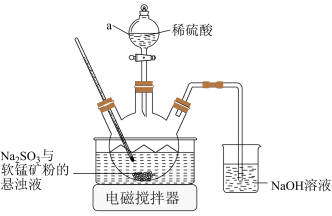
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近半年使用:0次
名校
4 . 亚氯酸钠 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
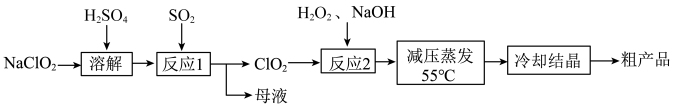
已知:①亚氯酸钠 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。
(1) 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的______ 倍(保留小数点后一位)。“反应1”需要鼓入空气,空气的作用是______ 。
(2)“反应2”发生反应的化学方程式:______ 。“反应2”需要控制反应温度不能过高,温度过高可能导致______ 。
(3)从“母液”中可回收的主要物质是______ 。
(4)为探究 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂______ 。根据选择的试剂,描述能体现 氧化性的实验现象是
氧化性的实验现象是______
A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液
 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
已知:①亚氯酸钠
 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。(1)
 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的(2)“反应2”发生反应的化学方程式:
(3)从“母液”中可回收的主要物质是
(4)为探究
 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂 氧化性的实验现象是
氧化性的实验现象是A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D.
 溶液
溶液
您最近半年使用:0次
5 . 锇酸钾晶体(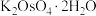 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约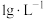 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量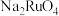 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
(1)“沉锇”得到难溶物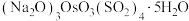 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为_______ 。
(2)检验滤液1和滤液2中金属阳离子的实验方法是_______ 。
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为_______ 。
(4) 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量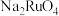 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是___________________________________ 。
(5)“转化”时须加入过量 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因____________________________ 。
(6)已知: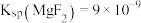 、
、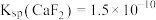 。
。
锇吸收液中 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入_______ g 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
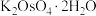 )微溶于冷水,常用作催化剂。由含锇约
)微溶于冷水,常用作催化剂。由含锇约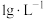 的锇吸收液(主要成分为
的锇吸收液(主要成分为 ,含少量
,含少量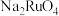 及
及 、
、 杂质)精制提纯锇酸钾的工业流程如下:
杂质)精制提纯锇酸钾的工业流程如下: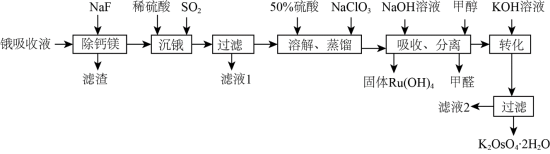
 )的熔点为41℃,沸点为130℃,易挥发。回答下列问题:
)的熔点为41℃,沸点为130℃,易挥发。回答下列问题:(1)“沉锇”得到难溶物
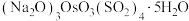 ,该化合物中锇元素的化合价为
,该化合物中锇元素的化合价为(2)检验滤液1和滤液2中金属阳离子的实验方法是
(3)“溶解、蒸馏”步骤中,先加入50%硫酸得到
 溶液,再加入
溶液,再加入 反应后蒸馏出
反应后蒸馏出 ,生成
,生成 的离子反应方程式为
的离子反应方程式为(4)
 用
用 溶液吸收后又得到
溶液吸收后又得到 溶液,吸收液中仍然存在少量
溶液,吸收液中仍然存在少量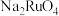 杂质,“吸收、分离”操作加入甲醇的目的是
杂质,“吸收、分离”操作加入甲醇的目的是(5)“转化”时须加入过量
 溶液,用平衡原理解释其原因
溶液,用平衡原理解释其原因(6)已知:
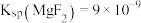 、
、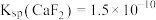 。
。锇吸收液中
 、
、 浓度分别为
浓度分别为 和
和 ,若取1.0L废液,则至少需加入
,若取1.0L废液,则至少需加入 才能使废液中
才能使废液中 、
、 沉淀完全(当离子浓度
沉淀完全(当离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
您最近半年使用:0次
名校
解题方法
6 .  可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: 。
。
回答下列问题:
(1) 的空间结构为
的空间结构为_______ ,若在实验室进行“酸浸”,则不能使用玻璃仪器,原因是_______ 。
(2)滤渣1的主要成分是_______ (填化学式,下同),滤渣2的主要成分是_______ 。
(3)写出加入 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:_______ 。
(4)已知 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是_______ ,沉铈过程中会有一种气体产生,该气体是_______ (填化学式)。
(5) 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为_______ 。
(6)常温下, ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
_______  。
。
 可用于催化剂载体及功能材料的制备。天然独居石的主要成分为
可用于催化剂载体及功能材料的制备。天然独居石的主要成分为 ,还含有
,还含有 等物质。以独居石为原料制备
等物质。以独居石为原料制备 的工艺流程如图所示:
的工艺流程如图所示: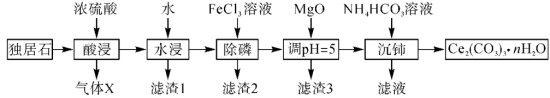
 。
。回答下列问题:
(1)
 的空间结构为
的空间结构为(2)滤渣1的主要成分是
(3)写出加入
 、调
、调 时,生成沉淀的一个离子方程式:
时,生成沉淀的一个离子方程式:(4)已知
 溶液显弱碱性,则
溶液显弱碱性,则 三者大小关系是
三者大小关系是(5)
 与
与 、单质碳在高温下反应可得到用于制备电极材料的
、单质碳在高温下反应可得到用于制备电极材料的 ,同时伴随产生一种可燃性气体,反应的化学方程式为
,同时伴随产生一种可燃性气体,反应的化学方程式为(6)常温下,
 ,若
,若 恰好沉淀完全
恰好沉淀完全 时溶液的
时溶液的 ,则溶液中
,则溶液中
 。
。
您最近半年使用:0次
2024-03-03更新
|
148次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
7 . 下列过程中的化学反应,相应的离子方程式正确的是
A.澄清石灰水中滴加少量 溶液: 溶液: |
B.用银氨溶液检验乙醛中的醛基: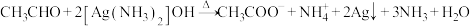 |
C.铅酸蓄电池充、放电原理: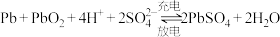 |
D.过量铁粉加入稀硝酸中: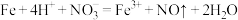 |
您最近半年使用:0次
2024-03-03更新
|
133次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
解题方法
8 . 以某种铁钴矿(主要成分为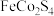 ,还含有少量
,还含有少量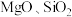 等杂质)为原料制取
等杂质)为原料制取 和黄钠铁矾的工艺流程如下图所示:
和黄钠铁矾的工艺流程如下图所示:
(1)滤渣3的主要成分为___________ ;确定“滤液1”中的 已被完全氧化的方法是
已被完全氧化的方法是___________ 。
(2)向“溶液A”中加入适量的 溶液,生成颗粒较大的黄钠铁矾[
溶液,生成颗粒较大的黄钠铁矾[ ]沉淀的同时还生成一种气体,这种气体的化学式是
]沉淀的同时还生成一种气体,这种气体的化学式是___________ 。
(3)向“滤液3”中按物质的量之比为 加入
加入 和
和 ,若“滤渣4”的成分为
,若“滤渣4”的成分为 ,总反应的离子方程式是
,总反应的离子方程式是___________ 。经检测,“滤渣4”是由 和
和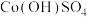 形成的混合物。隔绝空气灼烧时,
形成的混合物。隔绝空气灼烧时,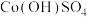 发生反应的化学方程式是
发生反应的化学方程式是___________ ;如果控制温度不当, 会生成
会生成 杂质,反应的化学方程式是
杂质,反应的化学方程式是___________ 。
(4)向“滤液1”中加入的“ 溶液”须控制用量,请解释原因
溶液”须控制用量,请解释原因___________ 。
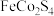 ,还含有少量
,还含有少量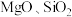 等杂质)为原料制取
等杂质)为原料制取 和黄钠铁矾的工艺流程如下图所示:
和黄钠铁矾的工艺流程如下图所示:
(1)滤渣3的主要成分为
 已被完全氧化的方法是
已被完全氧化的方法是(2)向“溶液A”中加入适量的
 溶液,生成颗粒较大的黄钠铁矾[
溶液,生成颗粒较大的黄钠铁矾[ ]沉淀的同时还生成一种气体,这种气体的化学式是
]沉淀的同时还生成一种气体,这种气体的化学式是(3)向“滤液3”中按物质的量之比为
 加入
加入 和
和 ,若“滤渣4”的成分为
,若“滤渣4”的成分为 ,总反应的离子方程式是
,总反应的离子方程式是 和
和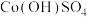 形成的混合物。隔绝空气灼烧时,
形成的混合物。隔绝空气灼烧时,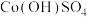 发生反应的化学方程式是
发生反应的化学方程式是 会生成
会生成 杂质,反应的化学方程式是
杂质,反应的化学方程式是(4)向“滤液1”中加入的“
 溶液”须控制用量,请解释原因
溶液”须控制用量,请解释原因
您最近半年使用:0次
2024-03-01更新
|
652次组卷
|
3卷引用:山东省实验中学2023-2024学年高三(一模)调研考试化学试题
山东省实验中学2023-2024学年高三(一模)调研考试化学试题(已下线)大题预测卷(黑龙江、吉林专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
名校
9 . 二氧化铅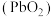 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
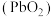 是一种强氧化剂,可以用作铅蓄电池的正极材料。
是一种强氧化剂,可以用作铅蓄电池的正极材料。 在酸性条件氧化
在酸性条件氧化 为
为 的方程式为
的方程式为 (方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是
(方程式未配平)。已知:双氧水可以使酸性高锰酸钾溶液褪色。下列说法正确的是A.X是 ,Y是 ,Y是 |
B.还原产物与氧化产物的物质的量之比为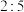 |
C.当生成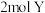 时,转移 时,转移 电子 电子 |
D.根据上述反应推测 不能氧化 不能氧化 |
您最近半年使用:0次
2024-02-27更新
|
188次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期开学化学试题
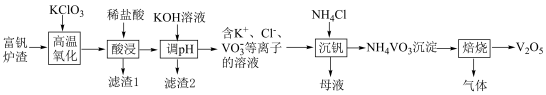
10 . 工业上以富钒炉渣(主要含FeO·V2O3、V2O5和少量的SiO2、Al2O3等)为原料制备V2O5的工艺流程如下:
已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
②Ksp[Fe(OH)3]=2.6×10–39;Ksp[Al(OH)3]=1.0×10–33;Ksp(NH4VO3)=1.6×10–3
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是___________ ;“高温氧化”过程中发生主要反应的化学方程式为___________ 。
(2)滤渣1的主要成分为___________ ;“调pH”时需将Fe3+、Al3+除尽(浓度≤1×10–5 mol∙L–1时,可认为已除尽),需调节pH的范围为___________ 。
(3)若“沉钒”前溶液中c(VO )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为___________ mol·L–1。过滤、洗涤、干燥得到NH4VO3沉淀,检验NH4VO3沉淀是否洗净的操作是___________ 。
(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为___________ 。

已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
| 溶液pH | <1.0 | 1.0~4.0 | 4.0~6.0 | 6.0~8.5 | 8.5~13.0 | >13.0 |
| 钒元素存在形式 | VO | V2O5 | 多矾酸根 | VO | 多矾酸根 | VO |
| 备注 | 多矾酸盐在水中溶解度较小 | |||||
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是
(2)滤渣1的主要成分为
(3)若“沉钒”前溶液中c(VO
 )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为
您最近半年使用:0次



