1 . 按要求完成以下填空:
(1)现有下列10种物质:①稀盐酸,②纯醋酸,③干冰,④H2SO4,⑤AgCl,⑥熔融硝酸钠,⑦液态氯化氢,⑧Ba(OH)2,⑨Al2O3,⑩C2H5OH
上述物质中能导电的是___________ (填序号),属于非电解质的有 ___________ (填序号),利用以上物质写出与离子方程式“H++OH- =H2O”相对应的一个化学方程式:___________ 。
(2)为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应2NO+2CO N2+2CO2。
N2+2CO2。
①用双线桥标出电子转移的方向和数目___________ (注明得失)。
②当消耗3g的NO时得到氧化产物的质量为___________ ,转移的电子的物质的量是 ___________ 。
(3)下列所列举的是3张在一定温度下物质的导电能力(σ)随新物质加入量(V)的变化曲线图,向饱和食盐水中不断通入二氧化碳相符的变化曲线图是___________ (填字母)。
A.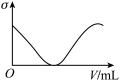 B.
B.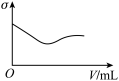 C.
C.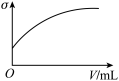
(1)现有下列10种物质:①稀盐酸,②纯醋酸,③干冰,④H2SO4,⑤AgCl,⑥熔融硝酸钠,⑦液态氯化氢,⑧Ba(OH)2,⑨Al2O3,⑩C2H5OH
上述物质中能导电的是
(2)为治理汽车尾气中的NO和CO对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应2NO+2CO
 N2+2CO2。
N2+2CO2。①用双线桥标出电子转移的方向和数目
②当消耗3g的NO时得到氧化产物的质量为
(3)下列所列举的是3张在一定温度下物质的导电能力(σ)随新物质加入量(V)的变化曲线图,向饱和食盐水中不断通入二氧化碳相符的变化曲线图是
A.
 B.
B. C.
C.
您最近半年使用:0次
名校
解题方法
2 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
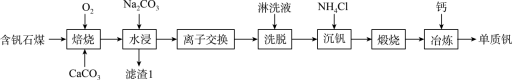
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②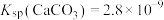 ,
,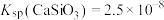 ,
,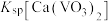 远大于
远大于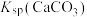 。
。
回答下列问题:
(1)基态Fe3+的价电子轨道表示式为______ 。
(2)“焙烧”时,V2O3、V2O4都转化为 ,写出
,写出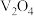 转化为
转化为 的化学方程式:
的化学方程式:____________ 。
(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有______ :“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是______ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,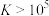 时反应进行较完全,
时反应进行较完全,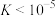 时反应难以进行)
时反应难以进行)
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,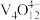 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用______ 。
(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是____________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
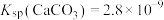 ,
,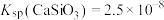 ,
,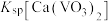 远大于
远大于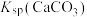 。
。回答下列问题:
(1)基态Fe3+的价电子轨道表示式为
(2)“焙烧”时,V2O3、V2O4都转化为
 ,写出
,写出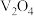 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
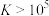 时反应进行较完全,
时反应进行较完全,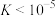 时反应难以进行)
时反应难以进行)(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,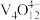 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近半年使用:0次
3 . 利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
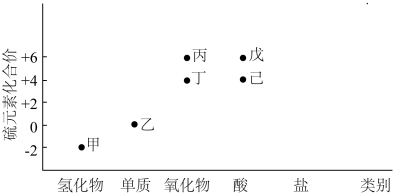
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为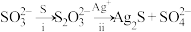 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为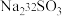 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为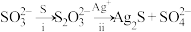 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为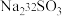 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近半年使用:0次
解题方法
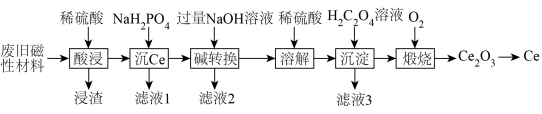
4 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
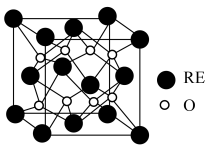
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近半年使用:0次
5 . 下列离子方程式正确且与所给事实相符的是
A.某电子厂制作印刷电路板: |
B.用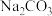 溶液除去锅炉水垢中的 溶液除去锅炉水垢中的 : :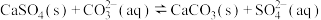 |
C.混用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)会发生氯气中毒: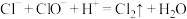 |
D.用 作抗胃酸药: 作抗胃酸药: |
您最近半年使用:0次
6 . 宏观辨识与微观探析是化学核心素养之一、下列物质性质与用途对应的离子方程式书写正确的是
A. 氧化海带灰酸性浸出液提取碘: 氧化海带灰酸性浸出液提取碘: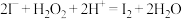 |
B. 与水反应用作潜水艇氧气来源: 与水反应用作潜水艇氧气来源: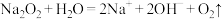 |
C.绿矾处理含 的酸性废水: 的酸性废水: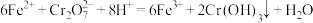 |
D.向 溶液中通入氨气可制备抗酸药 溶液中通入氨气可制备抗酸药 : :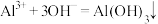 |
您最近半年使用:0次
7 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
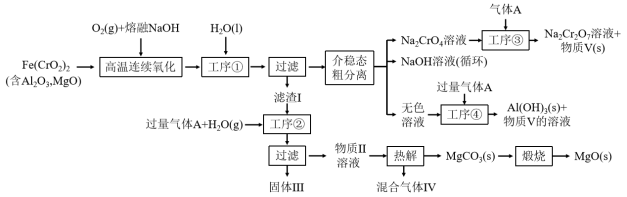
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号),Cr元素在元素周期表中的位置_______ ,
(2)滤渣I的主要成分是_______ (填化学式)。
(3)工序③中发生反应的离子方程式为_______ 。
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为_____ 。钠在火焰上灼烧产生的黄光是一种_______ (填“吸收光谱” 或“发射光谱”)。
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH-⇌Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
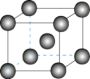
(6)基态Al原子的核外电子排布式为_______ 。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为a nm,则Fe晶胞的密度为_______ g•cm-3(用含NA和a的代数式表示)。

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)(6)基态Al原子的核外电子排布式为

您最近半年使用:0次
名校
解题方法
8 . 下列离子方程式书写正确的是
A.向 溶液中滴加稀硫酸: 溶液中滴加稀硫酸: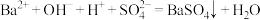 |
B.向 溶液中通入足量 溶液中通入足量 : :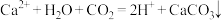 |
C.向 溶液中加入 溶液中加入 : :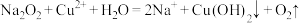 |
D.二氧化锰和浓盐酸反应: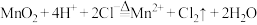 |
您最近半年使用:0次
名校
解题方法
9 . 请默写下列方程式。
(1)写出NH3与氧气发生催化氧化反应的化学方程式:_______ 。
(2)浓硝酸见光分解的化学方程式:_______ 。
(3)浓硝酸和铜反应的化学方程式:_______ 。
(4)硫化氢和二氧化硫气体混合的化学方程式:_______ 。
(5)二氧化氮通入水中反应的离子方程式:_______ 。
(1)写出NH3与氧气发生催化氧化反应的化学方程式:
(2)浓硝酸见光分解的化学方程式:
(3)浓硝酸和铜反应的化学方程式:
(4)硫化氢和二氧化硫气体混合的化学方程式:
(5)二氧化氮通入水中反应的离子方程式:
您最近半年使用:0次
解题方法
10 . 某同学利用钠与硫酸铜溶液进行实验,并对其现象进行分析,研究其产物组成。
(1)硫酸铜溶液的配制:准确称取五水硫酸铜(CuSO4·5H2O)晶体2.5000g,溶解后转移至100mL容量瓶中。
①上述实验过程中,用不到的实验仪器有____ (填标号)。

②该CuSO4溶液的浓度为__________ mo/L。
③通过理论计算,当上述硫酸铜与钠完全反应,溶液质量变化为___ g。
(2)将配好的CuSO4溶液,分3组进行实验,实验结果如下图所示:
查阅资料得知:极细的铜粉,外观呈现黑色
①a组中的蓝色沉淀成分主要是_________ 。
②将c组中黑色沉淀进行抽滤,干燥,对其成分进行初步的猜想
猜想ⅰ:金属钠将铜置换出来,以极细的铜粉存在;
猜想ⅱ:金属钠与水反应剧烈放热,______________ 。
设计一个简单的实验,证明猜想ⅰ是错误的______________ 。
(3)为进一步验证黑色固体的成分,该同学求助实验室检测,得到黑色固体中含铜化合物主要有硫酸氧化铜[Cu2O(SO4)]、碱式硫酸铜[Cu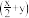 (OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式
(OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式____________ 。
(4)根据实验结果,可以得到的结论为____________ (写一条)。
(1)硫酸铜溶液的配制:准确称取五水硫酸铜(CuSO4·5H2O)晶体2.5000g,溶解后转移至100mL容量瓶中。
①上述实验过程中,用不到的实验仪器有

②该CuSO4溶液的浓度为
③通过理论计算,当上述硫酸铜与钠完全反应,溶液质量变化为
(2)将配好的CuSO4溶液,分3组进行实验,实验结果如下图所示:
| 序号 | CuSO4溶液体积/mL | 金属钠质量/g | 实验现象 |
| a | 15 | 0.01g | 迅速产生大量蓝色沉淀 |
| b | 15 | 0.1g | 蓝色沉淀和黑色沉淀共存 |
| c | 15 | 1.0g | 出现大量黑色沉淀 |
①a组中的蓝色沉淀成分主要是
②将c组中黑色沉淀进行抽滤,干燥,对其成分进行初步的猜想
猜想ⅰ:金属钠将铜置换出来,以极细的铜粉存在;
猜想ⅱ:金属钠与水反应剧烈放热,
设计一个简单的实验,证明猜想ⅰ是错误的
(3)为进一步验证黑色固体的成分,该同学求助实验室检测,得到黑色固体中含铜化合物主要有硫酸氧化铜[Cu2O(SO4)]、碱式硫酸铜[Cu
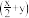 (OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式
(OH)x(SO4)y]、氧化铜[CuO]三种。写出钠与硫酸铜反应生成碱式硫酸铜的化学方程式(4)根据实验结果,可以得到的结论为
您最近半年使用:0次







