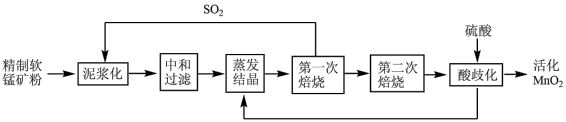
已知:蒸发结晶得到MnSO4。
(1)将软锰矿粉泥浆化的目的是
(2)“第一次焙烧”温度是1000℃,生成Mn3O4、SO2和O2,“第二次焙烧”温度为700℃,产物为Mn2O3;700℃时焙烧的氧化剂与还原剂物质的量比为
(3)“酸歧化”的离子方程式为
(4)活化MnO2中不能含有铜、铅等重金属元素,在“中和过滤”前需要加入某种盐溶液除去重金属离子,该盐的化学式是
(5)“第一次焙烧”每产生3molSO2,若完全转化为硫酸,理论上需要再充入空气
 ;②
;② ;③
;③ 可被酸性
可被酸性 氧化成
氧化成 ,现用下图所示装置制备
,现用下图所示装置制备 :
: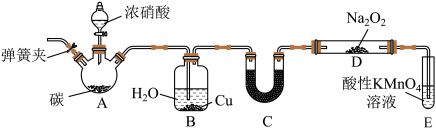
(1)连接仪器之后,加入药品之前需要进行的操作是
(2)仪器B中Cu的作用是
(3)U形管C中的试剂可以是
(4)试管E中反应的离子方程式为
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多,改进方法是
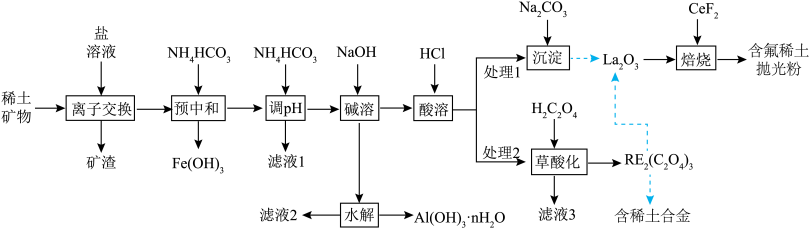
| 离子 |  |  |  |
| 开始沉淀时的pH | 1.5 | 4.3 | 5.6( 为6.2) 为6.2) |
| 沉淀完全时的pH | 3.2 | 5.5 | /( 为9.0) 为9.0) |
(1)“预中和”工序中:
①该工序适宜的pH范围是
②胶状
 的X射线衍射图谱中,
的X射线衍射图谱中,(2)“调pH”工序中,
 发生的离子反应方程式为
发生的离子反应方程式为(3)滤液3可返回
(4)“沉淀”工序产物为
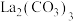 ”或“
”或“ ”),理由是
”),理由是 :
: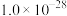 ]。(当反应的
]。(当反应的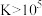 时可认为反应完全)
时可认为反应完全)(5)含氟稀土抛光粉的主要成分为
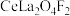 ,焙烧时发生的化学反应方程式为
,焙烧时发生的化学反应方程式为(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强.下列离子对
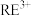 交换能力最强的是______。
交换能力最强的是______。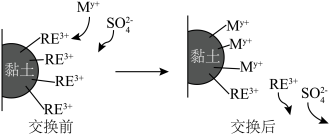
A. | B. | C. | D. |
(7)银铈合金是优良的导电材料,一种银铈晶体结构单元如图(a)所示:

②该晶体的化学式为
4 . Na2S2O3标准溶液是氧化还原反应中常用的还原性标定试剂,但是 固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用
固体通常含有一些杂质,且易风化和潮解,Na2S2O3溶液也容易被O2氧化。因此,Na2S2O3标准溶液配制好后常用 进行标定。但是由于
进行标定。但是由于 与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用
与Na2S2O3反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用 与过量的KI反应,定量生成
与过量的KI反应,定量生成 ,再用Na2S2O3滴定
,再用Na2S2O3滴定 ,发生反应的化学方程式为:
,发生反应的化学方程式为: 、
、 。我们将这种
。我们将这种 与
与 联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。
已知: 与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
(1)
 标准溶液的配制:
标准溶液的配制:①配制480 mL 0.1 mol/L的 标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、
②将下述实验步骤A到F按实验过程先后次序排列
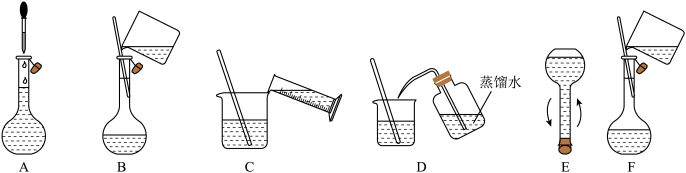
(2)
 标准溶液的标定:取20.00 mL 0.017 mol/L
标准溶液的标定:取20.00 mL 0.017 mol/L  溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用
溶液于250 mL锥形瓶中,加5 mL 6 mol/L HCl溶液,再加入10 mL 100 g/L KI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用 溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算
溶液滴定至浅黄色后加入2 mL淀粉指示剂,继续滴定至终点,平行测定3次,计算 标准溶液的浓度。
标准溶液的浓度。①用 溶液。
溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是
③如何判定滴定结束?
④列式并计算 标准溶液的浓度。
标准溶液的浓度。
| KI溶液 |
|
|
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
(3)借鉴(2)的方法,用碘量法测量
 溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L
溶液的物质的量浓度:量取25.00 mL待测液于250 mL锥形瓶中,加入2 mol/L  溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的
溶液25 mL,再加入10% KI溶液10 mL,然后用已知浓度的 溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用
溶液滴定到淡黄色,加0.5%的淀粉溶液3 mL,用 溶液继续滴定至终点。
溶液继续滴定至终点。①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?
②写出 溶液与KI反应的离子方程式
溶液与KI反应的离子方程式
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中
 的物质的量浓度。
的物质的量浓度。提出问题: 与
与 是可逆反应,
是可逆反应, 的存在是否会影响滴定?
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出 与
与 反应的离子方程式:
反应的离子方程式:
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用 溶液进行标定,发现消耗的
溶液进行标定,发现消耗的 溶液体积相同。
溶液体积相同。
实验小结: 是否会影响滴定:
是否会影响滴定:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol∙L-1 H2C2O4溶液 | H2O | 0.2mol∙L-1 KMnO4 | 3mol∙L-1稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | V1 | 4.0 |
| 2 | 2.0 | V2 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
5 H2C2O4+2
 +_______=2Mn2++_______+8H2O
+_______=2Mn2++_______+8H2O(2)实验过程使用了“控制变量法”,则V1=
(3)该小组同学查阅已有的资料后,提出假设:生成物中的MnSO4为该反应的催化剂,请你帮助该小组同学完成实验方案验证假设。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 2.0mol∙L-1 H2C2O4溶液 | H2O | 0.2mol∙L-1 KMnO4溶液 | 3mol∙L-1稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | _______ | t |
②若该小组同学提出的假设成立,应观察到的现象是
A.向 溶液中滴加稀硫酸出现黄色沉淀: 溶液中滴加稀硫酸出现黄色沉淀: |
B.向 溶液中加入 溶液中加入 出现红褐色沉淀: 出现红褐色沉淀: |
C.向酸性 溶液中通入 溶液中通入 后溶液紫色褪去: 后溶液紫色褪去: |
D.向 溶液中加入 溶液中加入 后溶液变为黄色: 后溶液变为黄色: |
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 ,分别取100ml溶液进行以下4组实验:
,分别取100ml溶液进行以下4组实验:①向其中加入过量盐酸,滴加过程中均无气泡和沉淀生成。
②用pH试纸检测溶液呈碱性。
③做焰色试验,发现火焰呈黄色。
④加入足量
 溶液,产生白色沉淀。
溶液,产生白色沉淀。(1)由步骤①可以判断一定不存在的离子有
(2)由以上实验操作能够判断的阳离子一定有
(3)①根据电中性原则能否确定含有
 :
:②请设计实验检验
 :
:③书写检验
 的离子方程式:
的离子方程式:(4)取实验①的酸性溶液加入铜片,产生气泡,经测定该气体为NO,溶液变蓝,请写出该反应的离子方程式:
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面(
 );⑤小苏打(
);⑤小苏打( );⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
);⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)回答下列问题:
(1)明矾的化学式为
 ,属于
,属于(2)小苏打的主要成分
 ,在水溶液的电离方程式:
,在水溶液的电离方程式:(3)厨卫用品的主要成分(括号内的物质)是电解质的有
(4)⑥和⑦不能混用,原理为
(5)已知
 和碱反应生成
和碱反应生成 ,故
,故 为酸性氧化物,
为酸性氧化物, 与酸反应生成
与酸反应生成 ,故
,故 为碱性氧化物.
为碱性氧化物. 可以形成两种盐:
可以形成两种盐: 、
、 (微溶物),则
(微溶物),则 属于
属于 与浓NaOH溶液反应的化学反应方程式:
与浓NaOH溶液反应的化学反应方程式: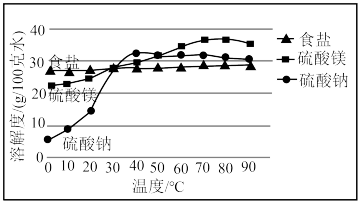
运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量
 和
和 ,将其溶解后依次加入
,将其溶解后依次加入 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是
 )的原理是
)的原理是(3)经提纯得到的
 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为(4)
 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示: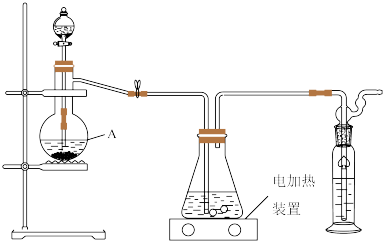
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入
 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.①仪器A的名称是
②锥形瓶内的反应大致可分为三步进行:
第一步:

第二步:

第三步:生成
 反应的化学方程式为
反应的化学方程式为 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是
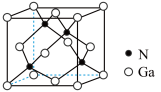
回答下列问题:
(1)镓原子结构示意图为
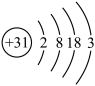 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为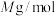 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。