1 . 钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为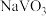 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。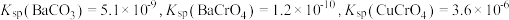 。
。
回答下列问题:
(1)基态铬原子价电子轨道表示式为_______ 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有_______ (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙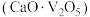 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是_______ 。
(4)“沉铬”时,铬转化为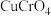 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为_______ 。
(5)向“沉钒后液”中加入足量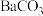 ,可将其中的铬转化为
,可将其中的铬转化为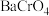 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为_______ (保留三位有效数字) 。
。
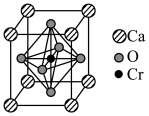
(6)复合材料氧铬酸钙的立方晶胞如下图所示。_______ 。
②已知该晶体的密度为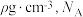 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与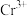 之间的最短距离为
之间的最短距离为_______ 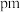 (列出计算式即可)。
(列出计算式即可)。
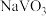 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。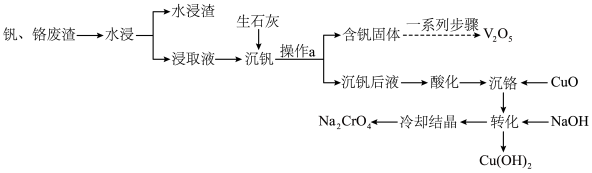
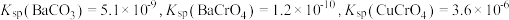 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
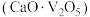 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
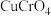 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
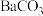 ,可将其中的铬转化为
,可将其中的铬转化为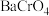 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
②已知该晶体的密度为
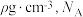 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与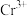 之间的最短距离为
之间的最短距离为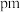 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
2024-02-27更新
|
503次组卷
|
3卷引用:广东省湛江市2024届高三下学期第二次模拟测试化学试题
广东省湛江市2024届高三下学期第二次模拟测试化学试题贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
2 . 化学离不开实验,请结合实验回答相应问题。
I.实验室需配制250mL浓度为 的
的 标准溶液进行有关实验。
标准溶液进行有关实验。
(1)配制时,先用托盘天平称取 固体
固体___________ g,然后进行下列操作,其中错误的是___________ (填标号)。
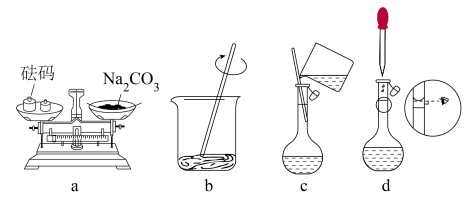
(2)下列有关容量瓶使用方法的操作中,正确的是___________(填标号)。
(3)___________ 
 的
的 溶液与
溶液与
 的盐酸恰好完全反应生成
的盐酸恰好完全反应生成 。
。
II.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计如下图所示的实验装置。
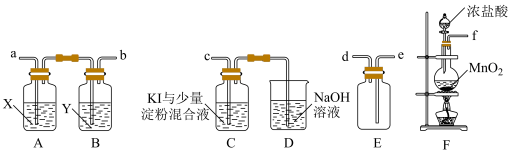
(4)整套装置的连接顺序是:f→___________ →c(按气体流动方向填各接口的小写字母,不重复)。
(5)B装置的作用是___________ 。
(6)某反应体系有反应物和生成物共7种: ,
, 、
、 、
、 、
、 、
、 、
、 ,已知该反应过程中产生气泡,则该反应中的还原剂是
,已知该反应过程中产生气泡,则该反应中的还原剂是___________ (填化学式),请正确书写该反应的化学方程式___________ 。
I.实验室需配制250mL浓度为
 的
的 标准溶液进行有关实验。
标准溶液进行有关实验。(1)配制时,先用托盘天平称取
 固体
固体
(2)下列有关容量瓶使用方法的操作中,正确的是___________(填标号)。
| A.容量瓶只能用于配制溶液,不能储存溶液。 |
| B.进行容量瓶检漏时,容量瓶倒置一次即可。 |
| C.容量瓶用蒸馏水洗涤干净后,可以自然晾干或者烘箱烘干。 |
D. 固体在烧杯里完全溶解后,立即将溶液转移到容量瓶中。 固体在烧杯里完全溶解后,立即将溶液转移到容量瓶中。 |
(3)

 的
的 溶液与
溶液与
 的盐酸恰好完全反应生成
的盐酸恰好完全反应生成 。
。II.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计如下图所示的实验装置。

(4)整套装置的连接顺序是:f→
(5)B装置的作用是
(6)某反应体系有反应物和生成物共7种:
 ,
, 、
、 、
、 、
、 、
、 、
、 ,已知该反应过程中产生气泡,则该反应中的还原剂是
,已知该反应过程中产生气泡,则该反应中的还原剂是
您最近半年使用:0次
3 . 电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
(1)请写出 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式___________ 。
(2)某研究性学习小组为测定 溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
①取少量待测液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是___________ 。
②溶液组成的测定:取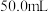 待测液,加入足量的
待测液,加入足量的 溶液,得到
溶液,得到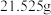 白色沉淀,则溶液中
白色沉淀,则溶液中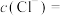
___________  。
。
(3)从腐蚀废液(主要含 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,废液处理流程如下:
溶液,废液处理流程如下:
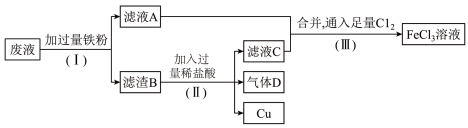
①滤渣B中主要含有___________ ,气体D是___________ 。
②写出步骤(Ⅲ)中生成 的化学方程式
的化学方程式___________ 。
③步骤(Ⅲ)中,将 换成
换成___________ 也能达到同样的目的,写出所换成的物质将 氧化为
氧化为 的离子方程式
的离子方程式___________ 。
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。(1)请写出
 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式(2)某研究性学习小组为测定
 溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:①取少量待测液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
②溶液组成的测定:取
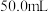 待测液,加入足量的
待测液,加入足量的 溶液,得到
溶液,得到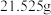 白色沉淀,则溶液中
白色沉淀,则溶液中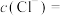
 。
。(3)从腐蚀废液(主要含
 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,废液处理流程如下:
溶液,废液处理流程如下:
①滤渣B中主要含有
②写出步骤(Ⅲ)中生成
 的化学方程式
的化学方程式③步骤(Ⅲ)中,将
 换成
换成 氧化为
氧化为 的离子方程式
的离子方程式
您最近半年使用:0次
名校
解题方法
4 .  是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
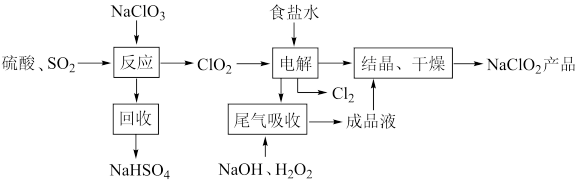
(1) 中
中 的化合价为
的化合价为_______ 。
(2)写出“反应步骤中生成 的化学方程式
的化学方程式_______ 。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应: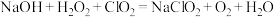
①配平化学方程式,并用单线桥表示电子转移方向和数目_______ 。
②此吸收反应中,氧化产物是_______ ,氧化剂与还原剂的个数比为_______ 。
③比较氧化性:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为_______  。(计算结果保留两位小数)
。(计算结果保留两位小数)
 是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应步骤中生成
 的化学方程式
的化学方程式(3)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应: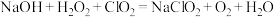
①配平化学方程式,并用单线桥表示电子转移方向和数目
②此吸收反应中,氧化产物是
③比较氧化性:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为 。(计算结果保留两位小数)
。(计算结果保留两位小数)
您最近半年使用:0次
名校
解题方法
5 . 碳酸锰MnCO3是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O >MnO
>MnO >
>
可能用到的数据如下:
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为_____ ,
(2)在实验室进行步骤A操作时,可能用到的主要仪器为_____ 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是_____ 。
(4)步骤G发生的离子方程式为___ ,若Mn2+恰好沉淀完全时测得溶液中CO 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=_____ (mol/L)2。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为_____ 。请写出对应的离子方程式_____ 。

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O
 >MnO
>MnO >
>
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O
 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为
您最近半年使用:0次
名校
解题方法
6 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原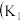 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
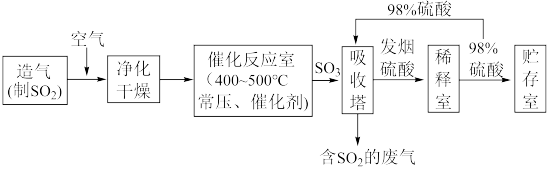
 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近半年使用:0次
2024-02-24更新
|
673次组卷
|
3卷引用:广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
7 . 实验室可由软锰矿(主要成分为 )制备
)制备 方法如下:
方法如下:
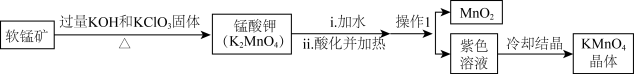
下列说法不正确的是
 )制备
)制备 方法如下:
方法如下:
下列说法不正确的是
A.软锰矿制锰酸钾时, 发生反应转移电子 发生反应转移电子 |
| B.实验室进行“操作1”时,玻璃棒的作用主要是引流 |
C.锰酸钾酸化过程氧化剂和还原剂的物质的量之比为 |
| D.酸化高锰酸钾溶液可用于消毒杀菌 |
您最近半年使用:0次
8 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
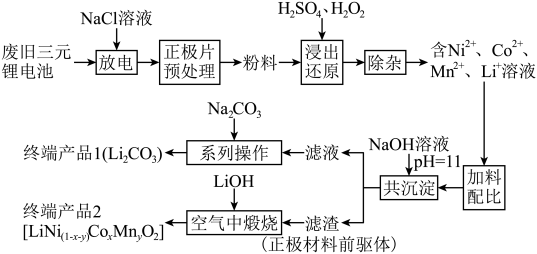
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
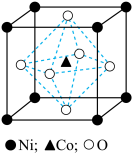
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近半年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
9 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
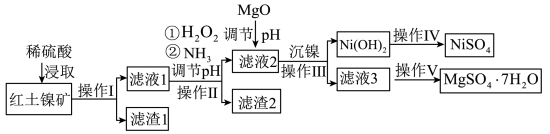
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近半年使用:0次
名校
解题方法
10 . 运动会上的发令枪所用“火药”的主要成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式(未配平): ,则下列有关叙述错误的是
,则下列有关叙述错误的是
 ,则下列有关叙述错误的是
,则下列有关叙述错误的是A.该反应属于氧化还原反应,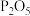 为氧化反应的产物 为氧化反应的产物 |
| B.该反应中n(氧化剂):n(还原剂)=6:5 |
| C.该反应中消耗2molP时,转移10mol电子 |
D.白烟是由于剧烈反应生成的白色固体小颗粒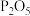 和KCl化合价 和KCl化合价 |
您最近半年使用:0次



