1 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
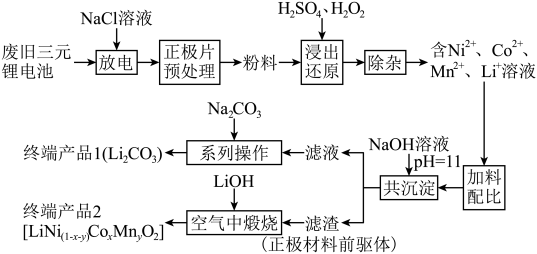
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为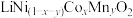 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的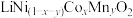 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
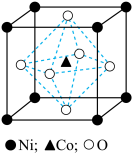
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
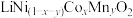 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
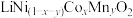 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
2 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
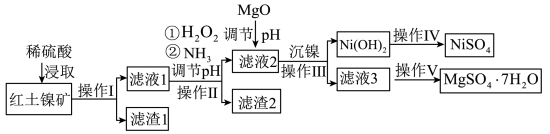
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近一年使用:0次
3 . 2023年化学诺贝尔奖授予三位科学家以表彰他们发现和合成量子点方面做出的贡献.我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)氮化碳( )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是
 )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是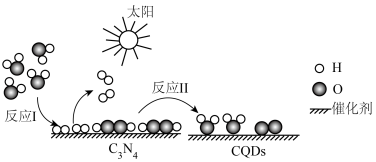
A.反应Ⅰ的化学方程式为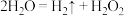 |
| B.该过程涉及太阳能、热能及化学能之间的转化 |
C.该过程实现高效分解水的同时也产生副产物 |
D.若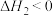 ,则 ,则 与 与 的大小关系为 的大小关系为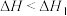 |
您最近一年使用:0次
2024-02-22更新
|
128次组卷
|
2卷引用:广东省东莞市两校联考2023-2024学年高二下学期4月月考化学试题
名校
解题方法
4 . 运动会上的发令枪所用“火药”的主要成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式(未配平): ,则下列有关叙述错误的是
,则下列有关叙述错误的是
 ,则下列有关叙述错误的是
,则下列有关叙述错误的是A.该反应属于氧化还原反应,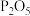 为氧化反应的产物 为氧化反应的产物 |
| B.该反应中n(氧化剂):n(还原剂)=6:5 |
| C.该反应中消耗2molP时,转移10mol电子 |
D.白烟是由于剧烈反应生成的白色固体小颗粒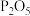 和KCl化合价 和KCl化合价 |
您最近一年使用:0次
名校
解题方法
5 .  是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
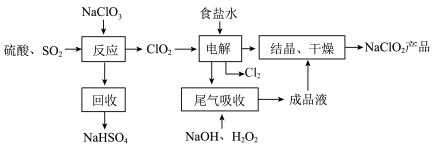
回答下列问题:
(1) 中
中 的化合价为
的化合价为___________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式___________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 ,要加入的试剂为
,要加入的试剂为___________ ,“电解”中还原产物是___________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为___________ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 ,要加入的试剂为
,要加入的试剂为(4)“尾气吸收”是吸收“电解”过程排出的少量
 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
6 . 某小组在探究 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。
资料:i.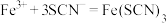 (红色),
(红色),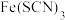 中
中 元素的化合价为
元素的化合价为 价
价
ii. 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了 的
的___________ 性,补全 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:___________ 。

(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是___________ 。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
分析上述三个实验,下列叙述不正确的是___________(填字母)。
(4)验证 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:___________ 。
 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。| 实验Ⅰ | 现象 |
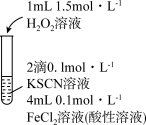 | 溶液变红,片刻红色褪去,有气体生成(经检验为 )。 )。 |
 (红色),
(红色), 中
中 元素的化合价为
元素的化合价为 价
价ii.
 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀(1)实验Ⅰ体现了
 的
的 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
| 实验Ⅲ | 现象 |
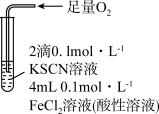 | 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和 溶液 溶液 | 无白色沉淀产生。 |
A.实验Ⅲ中发生了氧化还原反应: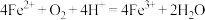 |
B.通过实验Ⅲ推出实验Ⅰ中氧化 的只有 的只有 |
C. 在该实验条件下不能使红色溶液褪色 在该实验条件下不能使红色溶液褪色 |
D.实验Ⅰ中红色褪去与 的氧化性有关 的氧化性有关 |
(4)验证
 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:
您最近一年使用:0次
2024·广东·模拟预测
名校
解题方法
7 . 含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是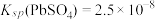 ;
;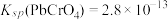 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
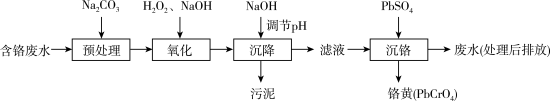
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
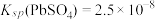 ;
;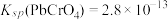 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
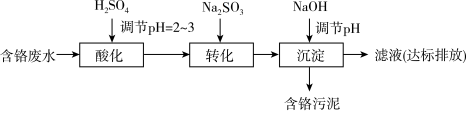
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近一年使用:0次
2024·广东·模拟预测
名校
解题方法
8 . 某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
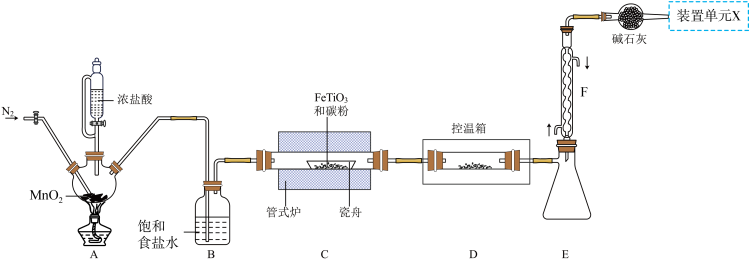
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知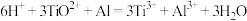 ,
,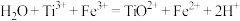
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
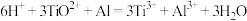 ,
,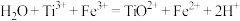
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近一年使用:0次
2024-02-19更新
|
909次组卷
|
3卷引用:2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题
(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
名校
解题方法
9 . 某废旧金属材料中主要含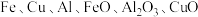 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收 、
、 、绿矾等。
、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去___________ 。
(2)“碱浸”时发生反应的化学方程式为___________ 。
(3)操作I、II中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是___________ 。
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为___________ 。
(5)①滤液II中可能含有因氧气的作用而产生少量杂质离子,该反应的离子方程式为___________ 。
②设计实验检验滤液II中是否含有上述杂质离子采用的试剂为___________ 溶液。
(6)若要定量测定所得绿矾纯度,可通过如下方法:称取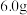 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性溶液,
的酸性溶液, 恰好完全反应时,消耗酸性
恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为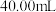 ,则
,则 的纯度为
的纯度为___________ 。(结果保留三位有效数字)已知: (未配平)
(未配平)
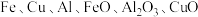 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收 、
、 、绿矾等。
、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的化学方程式为
(3)操作I、II中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为
(5)①滤液II中可能含有因氧气的作用而产生少量杂质离子,该反应的离子方程式为
②设计实验检验滤液II中是否含有上述杂质离子采用的试剂为
(6)若要定量测定所得绿矾纯度,可通过如下方法:称取
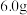 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性溶液,
的酸性溶液, 恰好完全反应时,消耗酸性
恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为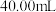 ,则
,则 的纯度为
的纯度为 (未配平)
(未配平)
您最近一年使用:0次
10 . 回答下列问题:
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①_______ ;②_______ ;③_______ 。
(2)HCO 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:_______ 。
(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
(4)等质量的O2和O3所含氧原子个数之比_______ 。
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为_______ 。
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有_______ 个C原子。
(7)请配平下面方程式:_______ 。
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:_______ 。
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①
(2)HCO
 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO
 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。A.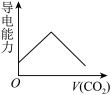 | B.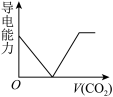 | C. | D.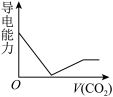 |
(4)等质量的O2和O3所含氧原子个数之比
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有
(7)请配平下面方程式:
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:
您最近一年使用:0次

 23.2
23.2

