1 . 人类社会的发展离不开“求知求真”.某化学兴趣小组以 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
(1)实验预测
(2)实验探究
实验一:探究 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有_______ [已知: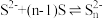 ]。
]。

实验二:探究 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:
实验结论
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
 溶液与
溶液与 溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。
溶液的反应为素材,探究盐溶液之间的反应情况,体悟反应的复杂性。(1)实验预测
| 推测可能发生的反应 | 推测依据 | 预期的实验现象 |
| ①氧化还原反应 |  具有一定的氧化性, 具有一定的氧化性, 具有较强的还原性 具有较强的还原性 | 若 过量,则有淡黄色沉淀(S)生成若 过量,则有淡黄色沉淀(S)生成若 过量,则有黑色沉淀 过量,则有黑色沉淀 |
| ②复分解反应 |  为黑色难溶物, 为黑色难溶物,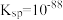 | 有黑色固体生成 |
| ③彻底双水解反应 |  、 、 水解能力均较强 水解能力均较强 | 有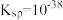 )产生,同时有臭鸡蛋气味的气体(H2S)生成 )产生,同时有臭鸡蛋气味的气体(H2S)生成 |
实验一:探究
 与
与 能否发生反应①,设计装置如下图,能证明反应已经发生的现象有
能否发生反应①,设计装置如下图,能证明反应已经发生的现象有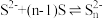 ]。
]。
实验二:探究
 与
与 能否发生反应②和③,设计如下实验:
能否发生反应②和③,设计如下实验:| 实验步骤 | 实验现象 | 实验解释或结论 |
ⅰ.向 饱和 饱和 溶液中,滴加2滴饱和 溶液中,滴加2滴饱和 溶液 溶液 | 有黑色沉淀生成,而后黑色沉淀消失,出现淡黄色沉淀 | 用离子方程式解释黑色沉淀消失的原因: |
ⅱ.将 饱和 饱和 溶液与 溶液与 饱和 饱和 溶液直接混合 溶液直接混合 | 先有黑色和另一种颜色的沉淀生成,而后都变为黑色;同时有臭鸡蛋气味的气体生成 | 试解释:沉淀最终都变为黑色的原因是 |
ⅲ.取ⅱ中最终生成的黑色沉淀样品,用无水乙醇多次洗涤后,干燥称量得 黑色固体,然后在空气中灼烧至恒重 黑色固体,然后在空气中灼烧至恒重 | 灼烧后,所得红棕色固体质量为 | 经计算判断,黑色固体样品的成份为 |
 与
与 在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
在溶液中相遇,会因为二者的浓度、用量等不同而反应不同,但都会先发生复分解反应。
您最近一年使用:0次
2 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:
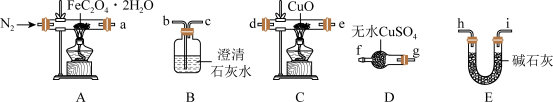
①E中盛装碱石灰的仪器名称为_________ 。
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→_____ →尾气处理装置(仪器可重复使用)。
③实验前先通入一段时间N2,其目的为__________________ 。
④实验证明了气体产物中含有CO,依据的实验现象为_____________ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为____________________ 。
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为______________ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为______________ ;步骤3中加入锌粉的目的为_______ 。
(5)草酸亚铁晶体样品的纯度为________ ;若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将____ (填“偏高”、“偏低”或“不变”)。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
③实验前先通入一段时间N2,其目的为
④实验证明了气体产物中含有CO,依据的实验现象为
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)草酸亚铁晶体样品的纯度为
您最近一年使用:0次
2019-03-16更新
|
649次组卷
|
3卷引用:【全国百强校】四川省成都七中2019届高三下学期二诊模拟考试化学试题
3 . 金属铝质轻且有良好的防腐蚀性,在国防工业、生产、生活中具有非常重要的作用。下图是从铝土矿中制备铝的工艺流程:
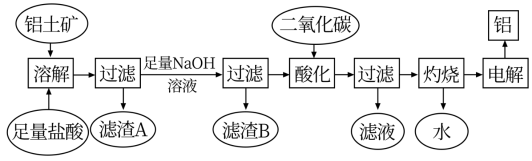
已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3、MgO杂质;
I.依据工艺流程回答下列问题:
(1)铝土矿加入盐酸过滤后所得滤渣A的主要成分为___________ 。
(2)在工艺流程中,加入足量氢氧化钠溶液发生多个离子反应,其中发生沉淀溶解的离子反应方程式为___________ 。
(3)加入过量的二氧化碳时,生成沉淀的离子方程式为___________ 。
II.测铝土矿组分的质量分数。
(4)若铝土矿样品质量为m,对滤渣A洗涤、干燥后称重为m1;对滤渣B洗涤、干燥、灼烧后称重为m2,该方案能测得铝土矿的成份及相应的质量分数的是(写出能测出成份的化学式,并写出计算其质量分数的表达式。)___________ ,___________ 。
(5)检测滤渣A是否洗涤干净的方法是___________ 。

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3、MgO杂质;
I.依据工艺流程回答下列问题:
(1)铝土矿加入盐酸过滤后所得滤渣A的主要成分为
(2)在工艺流程中,加入足量氢氧化钠溶液发生多个离子反应,其中发生沉淀溶解的离子反应方程式为
(3)加入过量的二氧化碳时,生成沉淀的离子方程式为
II.测铝土矿组分的质量分数。
(4)若铝土矿样品质量为m,对滤渣A洗涤、干燥后称重为m1;对滤渣B洗涤、干燥、灼烧后称重为m2,该方案能测得铝土矿的成份及相应的质量分数的是(写出能测出成份的化学式,并写出计算其质量分数的表达式。)
(5)检测滤渣A是否洗涤干净的方法是
您最近一年使用:0次
4 . 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]又名摩尔盐,是浅绿色晶体,易溶于水,是分析化学中的重要试剂。某化学兴趣小组对摩尔盐的一些性质进行探究。回答下列问题:
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知_______ 。
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。
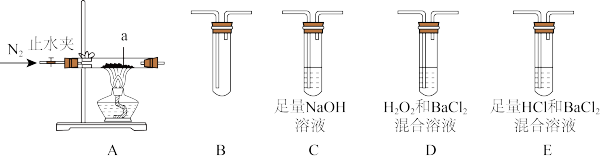
①a的名称是_______ 。装置B的作用_______ 。
②装置连接顺序为A→_______ →_______ →_______ →_______ (填字母序号)。
③能证明分解产物中有SO2的实验现象是_______ ,反应的离子方程式是_______ 。
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是_______ 。
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用_______ (填“酸式”或“碱式”)滴定管盛装KMnO4溶液。
②样品中Fe2+的质量分数为_______ (用含w、c、v的式子表示)。
(1)在试管中加入少量摩尔盐晶体,加水溶解,测得水溶液呈酸性。由此可知
(2)摩尔盐在500℃时隔绝空气加热完全分解,气体产物可能有NH3、SO2、SO3、H2O等。兴趣小组利用下图装置证明摩尔盐分解的气体产物中有SO2和SO3。

①a的名称是
②装置连接顺序为A→
③能证明分解产物中有SO2的实验现象是
④若装置连接顺序不变,能否将装置E中溶液换为BaCl2溶液?理由是
(3)为判断摩尔盐是否变质,可以测定样品中Fe2+的含量。取w g样品溶于水,配制成250 mL溶液。每次取25.00 mL溶液,用c mol/L的酸性KMnO4溶液滴定,滴定三次,平均消耗KMnO4溶液体积 v mL。
①滴定时,用
②样品中Fe2+的质量分数为
您最近一年使用:0次
名校
5 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。
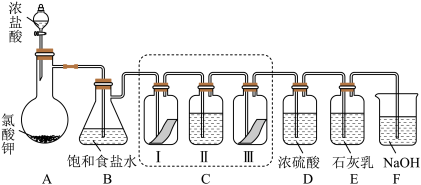
(1)用“双线桥”标出A中反应电子转移的方向和数目_______ 。
(2)B装置作用_______ 。
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是_______ (填编号)。
(4)为测定所得漂白粉的有效成分含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_______ ,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_______ (用含a、b的式子表示)。
已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)用“双线桥”标出A中反应电子转移的方向和数目
(2)B装置作用
(3)装置C的目的是验证氯气是否有漂白性,C中I、II、III依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
您最近一年使用:0次
名校
6 . 古代硫酸的制法是隔绝空气煅烧绿矾(FeSO4•7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________ 。
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U形管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→( ) (用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________ 。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加入足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________ 。
(1)绿矾油中溶质的化学式为
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U形管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→
② 写出煅烧绿矾的化学方程式
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加入足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为
您最近一年使用:0次
2017-08-26更新
|
178次组卷
|
2卷引用:江西省南昌市2018届高三摸底调研考试化学试题
名校
7 . 某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
(1)装置A中反应的化学方程式为________________________ 。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________ →_________ →C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________ ,通过______________________ 现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________ 。
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________ 。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________ 。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________ ,样品中Na2SO3质量分数是_____________ 。
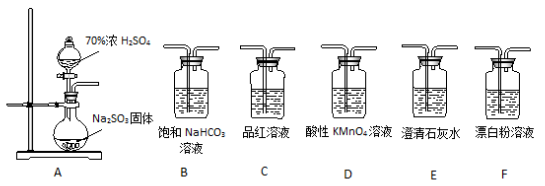
(1)装置A中反应的化学方程式为
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为
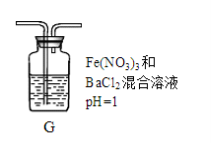
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是
您最近一年使用:0次
2017-07-04更新
|
323次组卷
|
2卷引用:江西省景德镇市第一中学2016-2017学年高二(素质班)下学期期末考试化学试题
解题方法
8 . 某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
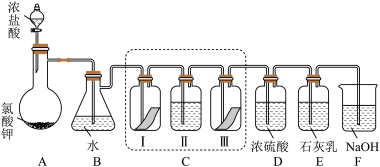
(1)写出 B 装置中反应的化学方程式_______________ 。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是______________ 。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________ (填编号)。
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其有效成份为____________ (填化学式)。
(4)F 装置的作用是(用离子方程式表示)_____________
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为_________________ (用含 a、b 的式子表示)。
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。

(1)写出 B 装置中反应的化学方程式
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是
| 编号 | I | II | III |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(4)F 装置的作用是(用离子方程式表示)
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2至不再产生沉淀为止,若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
|
9 . NaOH在存放过程中会发生变质。
(1)久置的NaOH溶液中含有CO32- ,请写出生成CO32-的离子方程式:_____________________ 。
(2)同学甲为确定某NaOH溶液的变质程度进行了如下实验:
①取少量溶液放入试管A中,然后加入BaCl2溶液,产生____________ (填实验现象),表明NaOH溶液已经变质。
②取少量溶液放入试管B中,先加入足量的BaCl2溶液后再向上层清液中加入____________ (填试剂名称),若溶液____________ ,则表明NaOH溶液是部分变质。
(3)同学乙经过思考认为,NaOH溶液变质后的产物可能含有NaHCO3。确定有无NaHCO3生成的方法:先向溶液中加入足量的BaCl2溶液,然后过滤除去沉淀,再__________________________ (答出所用试剂与实验现象),说明没有NaHCO3生成。
(4)同学丙利用如下方法测定某固体NaOH的变质程度:准确称取4.00g NaOH,配制成500 mL溶液,然后取出25. 00 mL所配溶液放入锥形瓶中,用0.2000mol·L-1的盐酸进行滴定
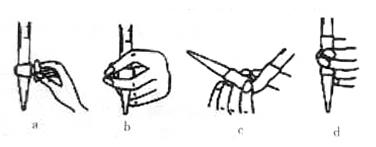
①取用NaOH 溶液的过程中涉及到排气泡的操作,其操作方式可用下图中的____________ 表示。
②滴定中使用了两种指示剂,先加入酚酞作指示剂,达到终点时消耗盐酸的体积为amL,然后加入几滴甲基橙作指示剂,继续滴定,达到终点时的实验现象为____________ ,若此过程中消耗盐酸的体积为bmL(a>b),则样品中n(NaOH)∶n(Na2CO3)=____________ 。
(1)久置的NaOH溶液中含有CO32- ,请写出生成CO32-的离子方程式:
(2)同学甲为确定某NaOH溶液的变质程度进行了如下实验:
①取少量溶液放入试管A中,然后加入BaCl2溶液,产生
②取少量溶液放入试管B中,先加入足量的BaCl2溶液后再向上层清液中加入
(3)同学乙经过思考认为,NaOH溶液变质后的产物可能含有NaHCO3。确定有无NaHCO3生成的方法:先向溶液中加入足量的BaCl2溶液,然后过滤除去沉淀,再
(4)同学丙利用如下方法测定某固体NaOH的变质程度:准确称取4.00g NaOH,配制成500 mL溶液,然后取出25. 00 mL所配溶液放入锥形瓶中,用0.2000mol·L-1的盐酸进行滴定
①取用NaOH 溶液的过程中涉及到排气泡的操作,其操作方式可用下图中的
②滴定中使用了两种指示剂,先加入酚酞作指示剂,达到终点时消耗盐酸的体积为amL,然后加入几滴甲基橙作指示剂,继续滴定,达到终点时的实验现象为
您最近一年使用:0次
10 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是__________ 。
①B装置的作用是______________ 。
②M干燥管中所放的药品是________________ 。
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是_______ (填化学式);检验是否完全变质的实验方法是___________________ 。
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O +2Fe2+ =2Fe3++2SO
+2Fe2+ =2Fe3++2SO )。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
①完成上述实验需要准确量取20.00 mL过二硫酸铵溶液,所用仪器的名称是______________ 。
②根据上述数据计算,样品的纯度为______________ (用含w、c的代数式表示)。

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是
①B装置的作用是
②M干燥管中所放的药品是
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O
 +2Fe2+ =2Fe3++2SO
+2Fe2+ =2Fe3++2SO )。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②根据上述数据计算,样品的纯度为
您最近一年使用:0次



