解题方法
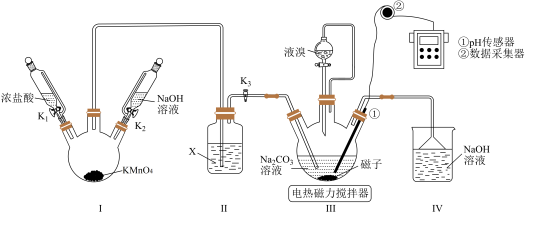
1 . 某小组利用“氯气氧化法”制备溴酸钠( ),并测定产品纯度。
),并测定产品纯度。
Ⅰ、制备
________________________________________ 。
(2)向装置Ⅲ通 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为________________ 。反应结束后,为避免Ⅰ中残留的 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是________________________ 。
Ⅱ、 的分离提纯
的分离提纯
(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液________________ 、过滤、洗涤、干燥,得到 粗产品。
粗产品。 产品纯度
产品纯度
步骤1:取 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。
(已知 、
、 ,杂质不反应)
,杂质不反应)
步骤2:另取 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)
(4)产品纯度为________________________ (用含m,c, ,
, 的代数式表示)。
的代数式表示)。
 ),并测定产品纯度。
),并测定产品纯度。Ⅰ、制备

(2)向装置Ⅲ通
 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是Ⅱ、
 的分离提纯
的分离提纯(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液
 粗产品。
粗产品。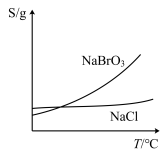
 产品纯度
产品纯度步骤1:取
 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。(已知
 、
、 ,杂质不反应)
,杂质不反应)步骤2:另取
 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)(4)产品纯度为
 ,
, 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
2 . I.回答下列问题:
(1)实验室中化学药品保存方法是由药品本身性质决定的,下列试剂保存方法不正确的是_______ 。
a.浓硝酸见光受热易分解,用棕色试剂瓶保存
b.浓硫酸、氢氧化钠溶液、碳酸钠溶液都不可以用带有玻璃塞的试剂瓶保存
c.硫酸亚铁溶液易被空气氧化,保存时常加入铁粉
d.液溴有挥发性,保存时应水封
Ⅱ.氮、磷元素存在于人体所有细胞中,几乎参与所有生理上的化学反应。磷元素有多种含氧酸,除了常见的磷酸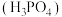 为三元中强酸外,还有次磷酸等弱酸,结合已学知识回答下列问题。
为三元中强酸外,还有次磷酸等弱酸,结合已学知识回答下列问题。
(2)次磷酸 可由
可由 与碘水反应制备,其化学反应方程式为
与碘水反应制备,其化学反应方程式为____ ; 和
和 比较,热稳定性较强的是
比较,热稳定性较强的是_______ 。
(3) 与过量
与过量 溶液反应生成的盐为
溶液反应生成的盐为 ,该盐属于
,该盐属于_____ (选填“酸式”、“正”)盐。
(4)由同主族元素性质的相似性可知, 属于
属于_______ (选填“离子”、“共价”)化合物, 含有的化学键类型为
含有的化学键类型为_______ 。
(1)实验室中化学药品保存方法是由药品本身性质决定的,下列试剂保存方法不正确的是
a.浓硝酸见光受热易分解,用棕色试剂瓶保存
b.浓硫酸、氢氧化钠溶液、碳酸钠溶液都不可以用带有玻璃塞的试剂瓶保存
c.硫酸亚铁溶液易被空气氧化,保存时常加入铁粉
d.液溴有挥发性,保存时应水封
Ⅱ.氮、磷元素存在于人体所有细胞中,几乎参与所有生理上的化学反应。磷元素有多种含氧酸,除了常见的磷酸
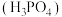 为三元中强酸外,还有次磷酸等弱酸,结合已学知识回答下列问题。
为三元中强酸外,还有次磷酸等弱酸,结合已学知识回答下列问题。(2)次磷酸
 可由
可由 与碘水反应制备,其化学反应方程式为
与碘水反应制备,其化学反应方程式为 和
和 比较,热稳定性较强的是
比较,热稳定性较强的是(3)
 与过量
与过量 溶液反应生成的盐为
溶液反应生成的盐为 ,该盐属于
,该盐属于(4)由同主族元素性质的相似性可知,
 属于
属于 含有的化学键类型为
含有的化学键类型为
您最近半年使用:0次
3 . 海洋是生命的摇篮,浩瀚的海洋中蕴藏着丰富的资源。
I.提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:___________ 。萃取后静置,进行___________ (填操作名称),可得到溴的有机溶液。
(2)“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO 与Br-物质的量之比为
与Br-物质的量之比为___________ 。
II.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:___________ (填字母)。
a.泥三角 b.坩埚 c.漏斗 d.250ml容量瓶 e.酒精灯
(4)步骤③的操作名称是___________ 。
(5)步骤④中反应的离子方程式为___________ 。
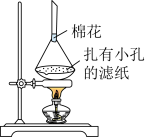
(6)利用如图装置,可以从氯化钠固体中分离出碘单质。___________ ;棉花的作用是___________ 。
I.提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:
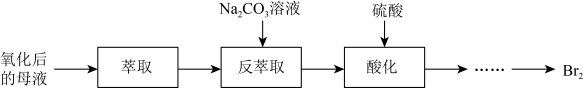
(2)“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO
 与Br-物质的量之比为
与Br-物质的量之比为II.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
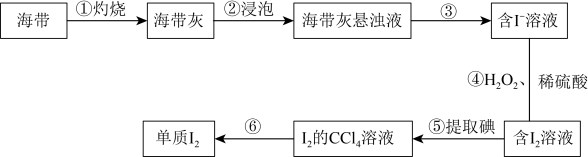
a.泥三角 b.坩埚 c.漏斗 d.250ml容量瓶 e.酒精灯
(4)步骤③的操作名称是
(5)步骤④中反应的离子方程式为
(6)利用如图装置,可以从氯化钠固体中分离出碘单质。
您最近半年使用:0次
名校
4 . 利用工业废气NO生产 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中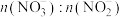 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是
 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中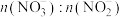 都为1∶1.下列说法错误的是
都为1∶1.下列说法错误的是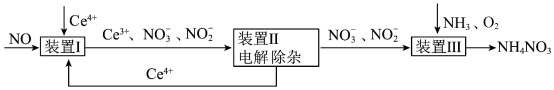
| A.装置江中若有5.6L(标准状况)NO参与反应,则转移1mol电子 |
B.装置Ⅰ中反应为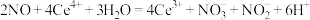 |
| C.装置Ⅲ中氧化剂和还原剂的物质的量之比为1∶2 |
D.装置Ⅲ中 和 和 的体积比3∶1时,可实现原子利用率最大化 的体积比3∶1时,可实现原子利用率最大化 |
您最近半年使用:0次
2024-04-10更新
|
84次组卷
|
2卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷
5 . 为验证卤素单质氧化性的相对强弱,某科学研究小组用如图所示装置进行实验(夹持仪器已略去,气密性以检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞 ,滴加浓盐酸。 Ⅱ.当 B和
,滴加浓盐酸。 Ⅱ.当 B和 中的溶液都变为黄色时,夹紧弹簧夹。
中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当 B中溶液由黄色变为橙黄色时,关闭活塞a。IV…
(1) 中产生黄绿色气体,其分子式是
中产生黄绿色气体,其分子式是_________ ,反应产生该气体的离子方程式为_________________ 。
(2)验证氯气的氧化性强于碘的实验现象是_____________ 。
(3)B中溶液发生反应的离子方程式是_____________ 。
(4)为验证溴的氧化性强于碘,过程IV的操作是_____________ 。

实验过程:
Ⅰ.打开弹簧夹,打开活塞
 ,滴加浓盐酸。 Ⅱ.当 B和
,滴加浓盐酸。 Ⅱ.当 B和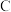 中的溶液都变为黄色时,夹紧弹簧夹。
中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当 B中溶液由黄色变为橙黄色时,关闭活塞a。IV…
(1)
 中产生黄绿色气体,其分子式是
中产生黄绿色气体,其分子式是(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程IV的操作是
您最近半年使用:0次
名校
解题方法
6 . 硝酸铈(Ⅳ)铵的化学式为(NH4)2Ce(NO3)6,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验步骤进行制备。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:
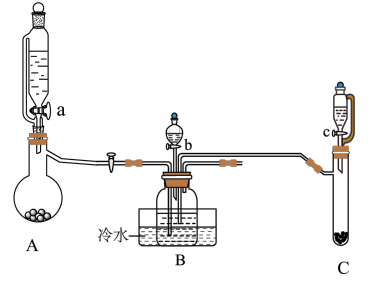
(1)装置A、C中相同仪器的名称为______ ,装置B中分液漏斗盛装的试剂是______ ,冷水浴的作用是______ 。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为______ 。装置B中发生反应的离子方程式有______ 、______ 。
(3)该实验装置存在的一处缺陷为______ 。
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为______ 。
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为______ 。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:

(1)装置A、C中相同仪器的名称为
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为
您最近半年使用:0次
名校
解题方法
7 . 金属镓( )是合成半导体材料砷化镓(
)是合成半导体材料砷化镓( )的重要基础材料,一种由砷化镓废料(主要成分
)的重要基础材料,一种由砷化镓废料(主要成分 ,含
,含 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。
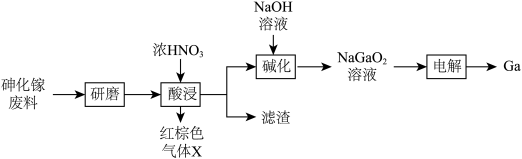
已知:
i. 和
和 位于同一主族,性质相似。
位于同一主族,性质相似。
ii. 难溶于水。
难溶于水。
(1)“研磨”的目的是_______ 。
(2)“滤渣”的主要成分是_______ (填化学式)。
(3)写出“酸浸”过程发生反应的化学方程式_______ 。若取A、B两组样品分别进行实验,“酸浸”时向A中不断通入 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
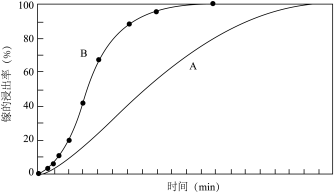
浸出速率A____ B(填>、=或<),推测A、B曲线变化的原因是______ 。
(4)“碱化”时发生反应的离子方程式为_______ 。
 )是合成半导体材料砷化镓(
)是合成半导体材料砷化镓( )的重要基础材料,一种由砷化镓废料(主要成分
)的重要基础材料,一种由砷化镓废料(主要成分 ,含
,含 、
、 等杂质)制备镓的实验流程如下。
等杂质)制备镓的实验流程如下。
已知:
i.
 和
和 位于同一主族,性质相似。
位于同一主族,性质相似。ii.
 难溶于水。
难溶于水。(1)“研磨”的目的是
(2)“滤渣”的主要成分是
(3)写出“酸浸”过程发生反应的化学方程式
 ,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
,其他条件、操作完全一样,得到镓元素的浸出率随时间变化情况如图所示:
浸出速率A
(4)“碱化”时发生反应的离子方程式为
您最近半年使用:0次
名校
8 . 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2
(1)在整个流程的反应中涉及到______ 种单质。
(2)煅烧时,Cr2O3发生反应的化学方程式为______ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有______ (填化学式),写出生成TeOSO4的离子方程式______ 。
(4)“还原”步骤生成碲单质的离子方程式为______ ,得到的粗碲经洗涤后可以得到较为纯净的碲单质,检验碲单质是否洗涤干净的实验操作:______ 。

已知:煅烧时,Cu2Te发生的反应为:Cu2Te+2O2→2CuO+TeO2
(1)在整个流程的反应中涉及到
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还含有
(4)“还原”步骤生成碲单质的离子方程式为
您最近半年使用:0次
9 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: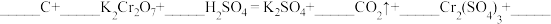
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
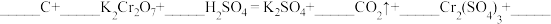
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近半年使用:0次
名校
解题方法
10 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定
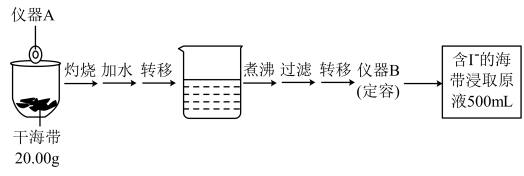
取100.00mL海带浸取原液于锥形瓶中,用 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
(1)仪器A的名称为_____ ;仪器B的名称为:_____ 。
(2)计算海带中碘的百分含量为_____ %。
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:

已知: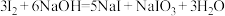 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。
(3)“适量 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为_____ 。
(4)下列有关步骤Y的说法,正确的是_____。
(5)方案乙中,上层液体加入 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:_____ ,其中操作Z的名称是_____ 。
实验(一)碘含量的测定

取100.00mL海带浸取原液于锥形瓶中,用
 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。(1)仪器A的名称为
(2)计算海带中碘的百分含量为
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:

已知:
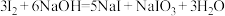 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。(3)“适量
 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为(4)下列有关步骤Y的说法,正确的是_____。
A.应控制 溶液的浓度和体积 溶液的浓度和体积 |
| B.将碘转化成离子进入水层 |
| C.主要是除浸取原液中的有机杂质 |
D. 溶液可由乙醇代替 溶液可由乙醇代替 |
(5)方案乙中,上层液体加入
 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:
您最近半年使用:0次



