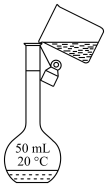
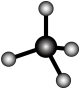
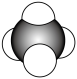
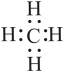1 . 氨气是化肥工业、有机化学工业和生产硝酸的主要原料。工业上常用如图所示的装置生产氨气,发生的反应为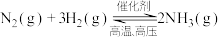 。氨气和以其为原料生产的化工产品广泛应用于工业、农业、国防、医药等各个领域。随着科学技术的发展,对氨的需要量日益增加,生产工艺也在不断进步。
。氨气和以其为原料生产的化工产品广泛应用于工业、农业、国防、医药等各个领域。随着科学技术的发展,对氨的需要量日益增加,生产工艺也在不断进步。
2.液氨可以作为汽车未来的新能源,反应为 。下列说法正确的是___________。
。下列说法正确的是___________。
3.下列有关物质性质与用途具有对应关系的是___________。
4.恒容密闭容器中发生可逆反应: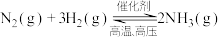 。下列说法错误的是___________。
。下列说法错误的是___________。
5.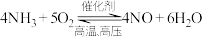 是硝酸工业中的一个反应。下列说法正确的是___________。
是硝酸工业中的一个反应。下列说法正确的是___________。
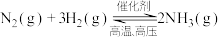 。氨气和以其为原料生产的化工产品广泛应用于工业、农业、国防、医药等各个领域。随着科学技术的发展,对氨的需要量日益增加,生产工艺也在不断进步。
。氨气和以其为原料生产的化工产品广泛应用于工业、农业、国防、医药等各个领域。随着科学技术的发展,对氨的需要量日益增加,生产工艺也在不断进步。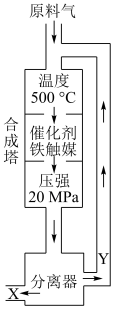
|
|
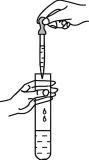
| A.向容量瓶中转移液体 | B.向试管内滴加液体 |
|
|
| C.氨气的收集装置 | D.量取液体时读数 |
| A.A | B.B | C.C | D.D |
 。下列说法正确的是___________。
。下列说法正确的是___________。A. 是氧化剂 是氧化剂 | B. 的氢元素被氧化 的氢元素被氧化 |
C. 发生还原反应 发生还原反应 | D. 中氧原子失去电子 中氧原子失去电子 |
A. 常温下性质稳定,可用作食品的保护气 常温下性质稳定,可用作食品的保护气 | B. 易溶于水,可用作制冷剂 易溶于水,可用作制冷剂 |
C. 受热易分解,可用作氮肥 受热易分解,可用作氮肥 | D.浓硝酸具有酸性,可用于钝化金属铝 |
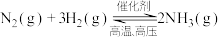 。下列说法错误的是___________。
。下列说法错误的是___________。A. 和 和 可完全转化为 可完全转化为 | B.平衡时,正、逆反应速率相等 |
C.充入 ,正、逆反应速率都降低 ,正、逆反应速率都降低 | D.平衡时, 、 、 和 和 的浓度一定相等 的浓度一定相等 |
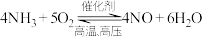 是硝酸工业中的一个反应。下列说法正确的是___________。
是硝酸工业中的一个反应。下列说法正确的是___________。| A.增大反应物浓度能加快反应速率 | B.降低温度能加快反应速率 |
| C.使用催化剂能加快反应速率 | D. 与 与 能100%转化为产物 能100%转化为产物 |
您最近一年使用:0次
解题方法
2 .  .根据题意解答。
.根据题意解答。
(1)下列反应中,属于放热反应的是___________ ,属于吸热反应的是___________ 。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为___________ 热反应。
 .如图所示为原电池装置。
.如图所示为原电池装置。___________ (填“负极”或“正极”),铁的电极反应式是___________ ,在铁电极上发生___________ 反应(填“氧化”或“还原”)。
 .根据题意解答。
.根据题意解答。(1)下列反应中,属于放热反应的是
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为
 .如图所示为原电池装置。
.如图所示为原电池装置。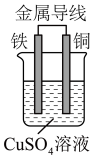
您最近一年使用:0次
解题方法
3 . 完成下列问题。
(1)从结构上分析基态 、
、 ,
,___________ 相对更稳定,原因是___________ 。
(2)苯胺( )中C与N原子的杂化类型分别为
)中C与N原子的杂化类型分别为___________ 。苯胺与甲苯( )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺___________ 甲苯(填“>”、“<”或“=”),原因是___________ 。
(3)磷元素可以形成多种含氧酸,已知次磷酸( )为一元弱酸,其结构式为:
)为一元弱酸,其结构式为:___________ 。
(4)砷(As)与硒(Se)同周期且相邻,比较它们的第一电离能大小___________ ,并说明原因___________ 。
(5)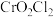 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断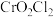 是
是___________ (填“极性”或“非极性”)分子。
(1)从结构上分析基态
 、
、 ,
,(2)苯胺(
 )中C与N原子的杂化类型分别为
)中C与N原子的杂化类型分别为 )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺(3)磷元素可以形成多种含氧酸,已知次磷酸(
 )为一元弱酸,其结构式为:
)为一元弱酸,其结构式为:(4)砷(As)与硒(Se)同周期且相邻,比较它们的第一电离能大小
(5)
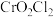 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断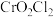 是
是
您最近一年使用:0次
解题方法
4 . 完成下列问题。
(1)计算下列分子或离子中中心原子的价电子对数。
①
___________ ②
___________ ③
___________ ④
___________ 。
(2)计算下列微粒中中心原子的孤电子对数。
①
___________ ②
___________ ③
___________ 。
(3)用价层电子对互斥模型推测下列分子或离子的立体构型。
①
___________ ;②
___________ ;③
___________ ;④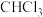
___________ ;⑤
___________ 。
(4)3-氯-2-丁氨酸的结构简式为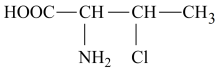 ,1个该有机物分子中含有
,1个该有机物分子中含有___________ 个手性碳原子,其中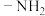 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是___________ 。
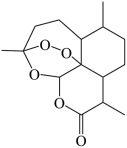
(5)青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如右图所示,则青蒿素分子中含有___________ 个手性碳原子。
(1)计算下列分子或离子中中心原子的价电子对数。
①




(2)计算下列微粒中中心原子的孤电子对数。
①



(3)用价层电子对互斥模型推测下列分子或离子的立体构型。
①



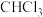

(4)3-氯-2-丁氨酸的结构简式为
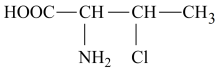 ,1个该有机物分子中含有
,1个该有机物分子中含有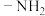 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是(5)青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如右图所示,则青蒿素分子中含有
您最近一年使用:0次
5 . 我国是世界上第一个在海域成功试采可燃冰的国家。可燃冰主要含有甲烷水合物,是由甲烷与水在高压低温条件下形成的类冰状的结晶物质,具有燃烧值高、污染小、储量大等特点,多呈白色或浅灰色晶体,外貌类似冰雪,用作新型高效能源。
1.甲烷( )属于___________。
)属于___________。
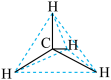
2.下列各图中能表示甲烷的分子结构有___________。
3.下列关于甲烷的说法中,正确的是___________。
4.如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和 ,用光照射烧瓶一段时间后,下列说法正确的是___________。
,用光照射烧瓶一段时间后,下列说法正确的是___________。
5.在一定条件下,下列物质可与甲烷发生化学反应的是___________。
1.甲烷(
 )属于___________。
)属于___________。| A.单质 | B.化合物 | C.碱 | D.有机物 |
|
|
| A.甲烷分子结构示意图 | B.甲烷分子电子式 |
|
|
| C.球棍模型 | D.填充模型 |
| A.A | B.B | C.C | D.D |
| A.是天然气、煤层气的主要成分 | B.比空气密度小且难溶于水的气体 |
| C.能与氯气发生取代反应 | D.分子结构是正四面体构型 |
 ,用光照射烧瓶一段时间后,下列说法正确的是___________。
,用光照射烧瓶一段时间后,下列说法正确的是___________。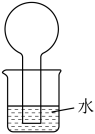
A.只能生成 一种有机物 一种有机物 | B.烧瓶内液面不可能上升 |
| C.烧瓶内的液体可能会分层 | D.向水中加入石蕊试液后变红 |
A. | B.浓硫酸 | C. | D.酸性 溶液 溶液 |
您最近一年使用:0次
6 . 空间站是一种可以提供多名航天员巡防、长期工作和生活的载人航天器。空间站 补充的一种方式是通过化学反应来生成。电解水可以生成
补充的一种方式是通过化学反应来生成。电解水可以生成 和
和 ,其中的
,其中的 可以直接供人类呼吸使用。
可以直接供人类呼吸使用。 在一定条件下与人类呼出的
在一定条件下与人类呼出的 反应生成
反应生成 和
和 ,然后又可以电解
,然后又可以电解 产生
产生 。这样就可以形成一个循环的反应链。
。这样就可以形成一个循环的反应链。
1.固态二氧化碳可用作制冷剂, 属于___________。
属于___________。
2.氢气可作为汽车的能源,反应为 。下列说法正确的是___________。
。下列说法正确的是___________。
3.在人体内, 与葡萄糖反应生成
与葡萄糖反应生成 和
和 的能量变化如图所示,下列说法不正确的是___________。
的能量变化如图所示,下列说法不正确的是___________。
4. 和
和 反应生成
反应生成 和
和 的反应为
的反应为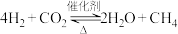 。下列关于该反应的说法正确的是___________。
。下列关于该反应的说法正确的是___________。
5.氢氧燃料电池可以使用在航天飞机上,其反应原理如图。下列说法正确的是___________。
 补充的一种方式是通过化学反应来生成。电解水可以生成
补充的一种方式是通过化学反应来生成。电解水可以生成 和
和 ,其中的
,其中的 可以直接供人类呼吸使用。
可以直接供人类呼吸使用。 在一定条件下与人类呼出的
在一定条件下与人类呼出的 反应生成
反应生成 和
和 ,然后又可以电解
,然后又可以电解 产生
产生 。这样就可以形成一个循环的反应链。
。这样就可以形成一个循环的反应链。1.固态二氧化碳可用作制冷剂,
 属于___________。
属于___________。| A.化合物 | B.氧化物 | C.盐 | D.有机物 |
 。下列说法正确的是___________。
。下列说法正确的是___________。A. 是氧化剂 是氧化剂 | B. 中氢元素被氧化 中氢元素被氧化 |
C. 发生还原反应 发生还原反应 | D. 是氧化产物又是还原产物 是氧化产物又是还原产物 |
 与葡萄糖反应生成
与葡萄糖反应生成 和
和 的能量变化如图所示,下列说法不正确的是___________。
的能量变化如图所示,下列说法不正确的是___________。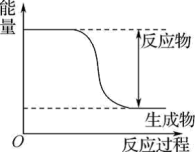
| A.该反应属于吸热反应 | B.断开氧气中的化学键会放出能量 |
| C.形成H—O吸收能量 | D.反应物的总能量大于生成物的总能量 |
 和
和 反应生成
反应生成 和
和 的反应为
的反应为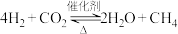 。下列关于该反应的说法正确的是___________。
。下列关于该反应的说法正确的是___________。| A.合适的催化剂能加快反应速率 | B.适当升高温度会加快化学反应速率 |
C.移除 能减慢化学反应速率 能减慢化学反应速率 | D.达到化学平衡时, 不能全部转化为 不能全部转化为 |
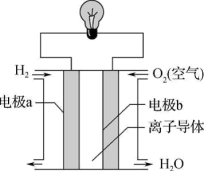
A.该电池的总反应: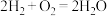 |
| B.该电池工作时化学能转化为电能 |
| C.外电路中电子由电极b通过导线流向电极a |
| D.该电池的离子导体可以选择稀硫酸,也可选择酒精溶液 |
您最近一年使用:0次
解题方法
7 . 完成下列问题。
(1) 、
、 常用作锂离子电池的正极材料。基态Co原子核外电子排布式为
常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___________ ,基态磷原子中,电子占据的最高能层符号为___________ ;该能层能量最高的电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(2)原子或离子半径的比较(以下均填:“>”或“<”)
①
___________ 
②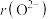
___________ 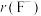
___________ 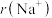
___________ 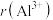 。
。
③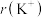
___________ r(Rb+),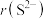
___________ 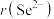 。
。
④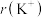
___________ 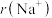
___________ 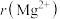 。
。
(1)
 、
、 常用作锂离子电池的正极材料。基态Co原子核外电子排布式为
常用作锂离子电池的正极材料。基态Co原子核外电子排布式为(2)原子或离子半径的比较(以下均填:“>”或“<”)
①


②
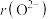
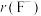
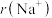
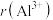 。
。③
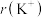
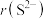
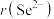 。
。④
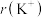
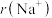
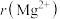 。
。
您最近一年使用:0次
解题方法
8 . 研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)自然界的氮循环如下图所示,①②③中属于自然固氮的过程为___________ ,该图是中人工固氮对应的反应方程式为___________ 。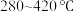 的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:___________ 。
(3)废水中氮的主要存在形态是硝态氮(以 存在)和氨氮(以NH3、NH
存在)和氨氮(以NH3、NH 存在),还原法和氧化法是去除废水中氮的重要方法。
存在),还原法和氧化法是去除废水中氮的重要方法。
①还原法:控制其他条件相同,去除pH=1的某含氮废水(废水中总氮 )中的硝态氮,图1为只加过量Na2SO3、图2为同时加过量Fe粉与Na2SO3时废水中含氮微粒的浓度随时间变化的图像。
)中的硝态氮,图1为只加过量Na2SO3、图2为同时加过量Fe粉与Na2SO3时废水中含氮微粒的浓度随时间变化的图像。___________ ;图2中 内发生主要反应的离子方程式为
内发生主要反应的离子方程式为___________ 。
②氧化法:利用NaClO将水体中氨氮氧化为N2。已知氧化性: ,还原性:NH3>NH
,还原性:NH3>NH 。研究发现,控制其他条件相同,当废水pH为
。研究发现,控制其他条件相同,当废水pH为 范围内,氨氮去除率随pH降低而升高,原因是
范围内,氨氮去除率随pH降低而升高,原因是___________ ;当废水pH为 范围内,氨氮去除率随pH降低而下降,原因是
范围内,氨氮去除率随pH降低而下降,原因是___________ 。
(1)自然界的氮循环如下图所示,①②③中属于自然固氮的过程为

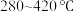 的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:(3)废水中氮的主要存在形态是硝态氮(以
 存在)和氨氮(以NH3、NH
存在)和氨氮(以NH3、NH 存在),还原法和氧化法是去除废水中氮的重要方法。
存在),还原法和氧化法是去除废水中氮的重要方法。①还原法:控制其他条件相同,去除pH=1的某含氮废水(废水中总氮
 )中的硝态氮,图1为只加过量Na2SO3、图2为同时加过量Fe粉与Na2SO3时废水中含氮微粒的浓度随时间变化的图像。
)中的硝态氮,图1为只加过量Na2SO3、图2为同时加过量Fe粉与Na2SO3时废水中含氮微粒的浓度随时间变化的图像。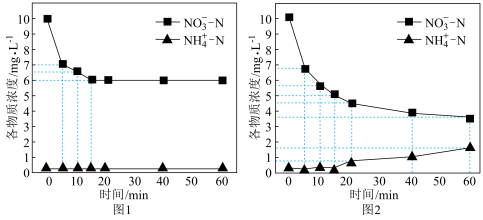
 内发生主要反应的离子方程式为
内发生主要反应的离子方程式为②氧化法:利用NaClO将水体中氨氮氧化为N2。已知氧化性:
 ,还原性:NH3>NH
,还原性:NH3>NH 。研究发现,控制其他条件相同,当废水pH为
。研究发现,控制其他条件相同,当废水pH为 范围内,氨氮去除率随pH降低而升高,原因是
范围内,氨氮去除率随pH降低而升高,原因是 范围内,氨氮去除率随pH降低而下降,原因是
范围内,氨氮去除率随pH降低而下降,原因是
您最近一年使用:0次
解题方法
9 . 根据氮及其化合物的转化关系回答下列问题:___________ ,从化合价上看,X 具有___________ 性(填“氧化”或“还原”)。
(2)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为___________ ;下列试剂不能用于干燥NH3的是 ___________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体 D.无水CaCl2
(3)设计从出发经过3步反应制备硝酸的路线___________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为___________ 。
(4)稀硝酸具有强氧化性,其与铜反应的化学方程式为___________ 。当有4 mol HNO3参与反应,转移的电子的物质的量为___________ mol。
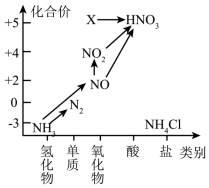
(2)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
A.浓硫酸 B.碱石灰 C.NaOH固体 D.无水CaCl2
(3)设计从出发经过3步反应制备硝酸的路线
(4)稀硝酸具有强氧化性,其与铜反应的化学方程式为
您最近一年使用:0次
10 . 研究硫及其化合物的应用价值对于社会发展意义重大。请回答以下问题。
(1)欲制备Na2S2O3,从氧化还原角度分析,下列方法合理的是___________(选填字母序号)。
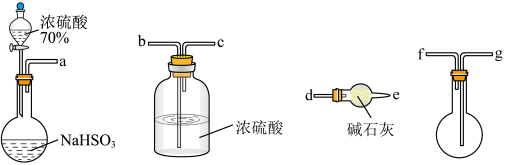
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为___________ ,装置的连接顺序为:a →___________ →e(按气流方向,用小写字母表示)。 (NH4)2SO3
(NH4)2SO3 (NH4)2SO4。
(NH4)2SO4。
①写出少量SO2通入氨水发生的离子方程式___________ 。
②某实验小组为测定步骤2溶液中(NH4)2SO3的氧化率α,设计了以下实验方案。
[提示:氧化率 ×100%]
×100%]
【方案一】一定条件下向100mL 1mol·L-1的(NH4)2SO3溶液中通入空气后,先加入足量的稀盐酸,充分反应后,再加入足量BaCl2溶液,过滤、洗涤、烘干,得到沉淀18.64g。则 (NH4)2SO3的氧化率α =___________ 。
【方案二】一定条件下向100mL c0mol·L-1的(NH4)2SO3溶液中通入空气后,取20.00mL反应后的溶液于锥形瓶中,用浓度为c mol·L-1的KMnO4标准溶液(经H2SO4酸化)滴定,滴定过程中锰元素被还原成Mn2+。重复操作三次,恰好完全反应时平均消耗KMnO4溶液的体积是V mL。该滴定过程反应的离子方程式为___________ ,(NH4)2SO3的氧化率α = ___________ 。
(1)欲制备Na2S2O3,从氧化还原角度分析,下列方法合理的是___________(选填字母序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO3 |
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为
 (NH4)2SO3
(NH4)2SO3 (NH4)2SO4。
(NH4)2SO4。①写出少量SO2通入氨水发生的离子方程式
②某实验小组为测定步骤2溶液中(NH4)2SO3的氧化率α,设计了以下实验方案。
[提示:氧化率
 ×100%]
×100%]【方案一】一定条件下向100mL 1mol·L-1的(NH4)2SO3溶液中通入空气后,先加入足量的稀盐酸,充分反应后,再加入足量BaCl2溶液,过滤、洗涤、烘干,得到沉淀18.64g。则 (NH4)2SO3的氧化率α =
【方案二】一定条件下向100mL c0mol·L-1的(NH4)2SO3溶液中通入空气后,取20.00mL反应后的溶液于锥形瓶中,用浓度为c mol·L-1的KMnO4标准溶液(经H2SO4酸化)滴定,滴定过程中锰元素被还原成Mn2+。重复操作三次,恰好完全反应时平均消耗KMnO4溶液的体积是V mL。该滴定过程反应的离子方程式为
您最近一年使用:0次