名校
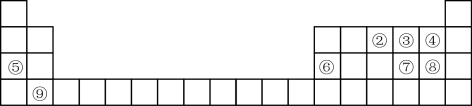
1 . 下表为元素周期表的一部分,用化学用语回答下列问题:___________ 。
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为___________ 。(写离子符号)
(3)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成CO 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式___________ 。
(4)将⑤和⑥单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积___________ L。最终获得溶液的物质的量浓度为___________ mol/L。
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为
(3)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成CO
 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式(4)将⑤和⑥单质各1mol投入足量水中,充分反应后,所得溶液体积为500mL,则该过程可得标况下气体体积
您最近一年使用:0次
名校
2 . 硫及其化合物的“价-类”二维图体现了化学变化之美。
(1)自然界中有斜方硫和单斜硫,它们的关系是___________ (填“同位素”或“同素异形体”),二者转化属于化学变化。
(2)如图中属于酸性氧化物的物质是___________ (用化学式表示)。___________ 。
(4)如果有反应Z M,H2S
M,H2S N,M是下列物质中的
N,M是下列物质中的___________ (填字母序号)。
a.Na2SO4 b.CuSO4 c.K2SO4 d.Fe2(SO4)3
Q可以是___________ (用化学式表示,写出至少2类物质)。
(5)S2Cl2和SCl2均为重要的化工产品。已知S4的结构式 和有关化学键能如下,则反应S4(g)+4Cl2(g)=4SCl2(g)
和有关化学键能如下,则反应S4(g)+4Cl2(g)=4SCl2(g)___________ (填“吸收”或“放出”)的能量为___________ mol。
(1)自然界中有斜方硫和单斜硫,它们的关系是
(2)如图中属于酸性氧化物的物质是

(4)如果有反应Z
 M,H2S
M,H2S N,M是下列物质中的
N,M是下列物质中的a.Na2SO4 b.CuSO4 c.K2SO4 d.Fe2(SO4)3
Q可以是
(5)S2Cl2和SCl2均为重要的化工产品。已知S4的结构式
 和有关化学键能如下,则反应S4(g)+4Cl2(g)=4SCl2(g)
和有关化学键能如下,则反应S4(g)+4Cl2(g)=4SCl2(g)| 化学键 | S-S | S-Cl | Cl-Cl |
| 键能/(kJ/mol) | 266 | 255 | 243 |
您最近一年使用:0次
3 . 根据已学知识,请回答下列问题:
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为_______ 。
(2)写出3p轨道上有2个未成对电子的元素的符号:_______ 。
(3)已知铬是24号元素,画出Cr的价层电子排布图:_______ 。
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序是_______ 。
(5)Zn2+的核外电子排布式为_______ 。
(1)基态N原子中,核外电子占据的最高能层的符号是L,占据该能层电子的原子轨道形状为
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)已知铬是24号元素,画出Cr的价层电子排布图:
(4)从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为
(5)Zn2+的核外电子排布式为
您最近一年使用:0次
4 . 完成下列问题。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式_______ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈____ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈_______ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_______ (填“向左移动”或“向右移动”),溶液颜色将_______ 。
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向_______ 反应方向移动,正反应为_______ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比 将
将_______ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向_______ 反应方向移动,A的质量分数_______ ,且m+n_______ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率_______ ,A的转化率_______ 。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向
 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
您最近一年使用:0次
名校
解题方法
5 . 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN-H会放出能量391kJ,则在反应N2+3H2 2NH3中,每生成2molNH3
2NH3中,每生成2molNH3_______ (填“吸收”或“放出”)热量_______ kJ。
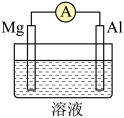
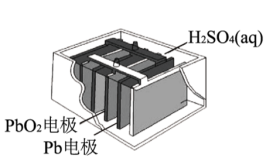
(2)Mg、Al设计成如图所示原电池装置:_______ 极,正极电极反应式为_______ 。
②若溶液为氢氧化钠溶液,负极的电极反应为_______ 。
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。_______ (填“正极”或“负极”);
②正极的电极反应式为_______ 。
③若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为_______ 。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN-H会放出能量391kJ,则在反应N2+3H2
 2NH3中,每生成2molNH3
2NH3中,每生成2molNH3(2)Mg、Al设计成如图所示原电池装置:
②若溶液为氢氧化钠溶液,负极的电极反应为
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
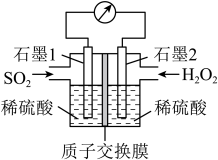
②正极的电极反应式为
③若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
您最近一年使用:0次
名校
6 . 汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应___________ (填“释放”或“吸收”)___________ kJ能量。
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从___________ (填“a”或“b”)处通入,正极反应方程式为___________ ,标况下消耗11.2L空气,整个电路中转移的电子数约为___________ NA。___________ ,负极电极反应式为___________ 。
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应




| A.NaN3属于离子化合物 |
| B.NaN3的分解反应属于吸热反应 |
| C.E1表示2mol NaN3固体的能量 |
| D.NaN3作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从
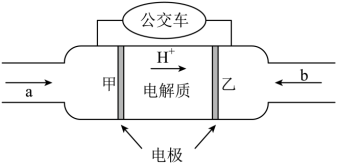
您最近一年使用:0次
7 . 下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
(1)金属性最强的元素是___________ (填元素符号)。最不活泼元素的原子结构示意图为___________ 。
(2)第3周期元素中,其最高价氧化物对应的水化物具有两性的元素是___________ (填元素名称)。Na、Mg两种元素中,原子半径较大的是___________ 。
(3)第3周期元素中,其元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为___________ 。
(4)工业上可以用Cl2和H2来制取盐酸,该反应的化学方程式为___________ 。
(5)由碳与氢元素形成的最简单有机物的化学式为___________ ,该物质中碳元素与氢元素的质量比为___________ ,其分子立体构型为___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | S | Cl |
(2)第3周期元素中,其最高价氧化物对应的水化物具有两性的元素是
(3)第3周期元素中,其元素的一种氧化物是形成酸雨的主要物质,该氧化物的化学式为
(4)工业上可以用Cl2和H2来制取盐酸,该反应的化学方程式为
(5)由碳与氢元素形成的最简单有机物的化学式为
您最近一年使用:0次
8 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
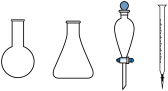
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示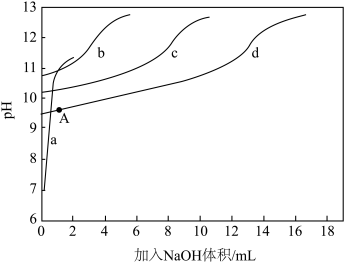
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
9 . 电解原理具有广泛的应用。某实验小组按照课本内容进行电解 溶液实验。
溶液实验。
(1)溶液配制:
①实验室在配制 溶液时需加入少许盐酸,目的是
溶液时需加入少许盐酸,目的是___________ ;氯化铜溶液中存在: (蓝色)
(蓝色) (黄色)
(黄色)
 ,加热盛有
,加热盛有 溶液的试管,试管中溶液颜色变为
溶液的试管,试管中溶液颜色变为___________ 。
②若要配制1000mL 2mol/L的 溶液,为使配制过程中不出现浑浊现象,至少需要滴加0.2mol/L的盐酸
溶液,为使配制过程中不出现浑浊现象,至少需要滴加0.2mol/L的盐酸___________ 滴。(已知: ,每滴溶液的体积约0.05mL,加入盐酸后溶液体积变化忽略不计)
,每滴溶液的体积约0.05mL,加入盐酸后溶液体积变化忽略不计)
(2)按下图装置进行电解饱和 溶液实验:阴极发生的电极反应为
溶液实验:阴极发生的电极反应为___________ ;阳极口放置湿润的淀粉 试纸可观察到
试纸可观察到___________ 。(填实验现象) 溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大量白色固体。
溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大量白色固体。
探究异常现象:
已知:ⅰ.相关物质颜色:铜(红色)、 (砖红色)、
(砖红色)、 (白色)、
(白色)、 (黄色,不稳定,易分解)。
(黄色,不稳定,易分解)。
ⅱ. 易溶于浓盐酸,
易溶于浓盐酸,
ⅲ. 在水中不稳定,易发生歧化反应。
在水中不稳定,易发生歧化反应。
经检验:红色固体中无 。
。
提出假设:红色固体是铜,白色固体是 。
。
验证假设:设计下表实验。
①上表中空格处应填写的内容是:Ⅰ___________ 、Ⅱ___________ 。
②实验B加水后出现白色沉淀的原因是___________ 。
结论:猜想正确。
(4)阴极生成 的电极反应式为
的电极反应式为___________ 。
 溶液实验。
溶液实验。(1)溶液配制:
①实验室在配制
 溶液时需加入少许盐酸,目的是
溶液时需加入少许盐酸,目的是 (蓝色)
(蓝色) (黄色)
(黄色)
 ,加热盛有
,加热盛有 溶液的试管,试管中溶液颜色变为
溶液的试管,试管中溶液颜色变为②若要配制1000mL 2mol/L的
 溶液,为使配制过程中不出现浑浊现象,至少需要滴加0.2mol/L的盐酸
溶液,为使配制过程中不出现浑浊现象,至少需要滴加0.2mol/L的盐酸 ,每滴溶液的体积约0.05mL,加入盐酸后溶液体积变化忽略不计)
,每滴溶液的体积约0.05mL,加入盐酸后溶液体积变化忽略不计)(2)按下图装置进行电解饱和
 溶液实验:阴极发生的电极反应为
溶液实验:阴极发生的电极反应为 试纸可观察到
试纸可观察到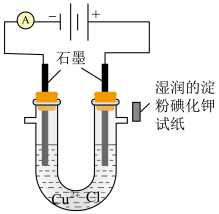
 溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大量白色固体。
溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大量白色固体。探究异常现象:
已知:ⅰ.相关物质颜色:铜(红色)、
 (砖红色)、
(砖红色)、 (白色)、
(白色)、 (黄色,不稳定,易分解)。
(黄色,不稳定,易分解)。ⅱ.
 易溶于浓盐酸,
易溶于浓盐酸,
ⅲ.
 在水中不稳定,易发生歧化反应。
在水中不稳定,易发生歧化反应。经检验:红色固体中无
 。
。提出假设:红色固体是铜,白色固体是
 。
。验证假设:设计下表实验。
| 序号 | 实验操作 | 实验现象 |
| A | 将有固体析出的石墨棒一端插入盛2mL稀硝酸试管中,反应完后取出,再向试管中滴加几滴 溶液 溶液 | 石墨棒上红色和白色物质都消失;无色溶液变Ⅰ,并有无色气体产生,在接近试管口处变红色;加入 溶液产生白色沉淀。 溶液产生白色沉淀。 |
| B | 将有固体析出的石墨棒一端插入盛2mLⅡ的试管中,反应完后取出,再向试管中加入一定量的水 | 石墨棒上红色固体不溶,白色固体消失,溶液无色;加水后出现白色沉淀。 |
②实验B加水后出现白色沉淀的原因是
结论:猜想正确。
(4)阴极生成
 的电极反应式为
的电极反应式为
您最近一年使用:0次
名校
10 . 利用元素的化合价推测物质的性质是化学研究的重要手段。硫及其化合物的“价—类”二维图如下:___________ (填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为___________ ;实验室常用热的氢氧化钠溶液洗去试管内壁附着的该淡黄色固体,其原理为___________ (用化学方程式表示)。
(3)检验N盐溶液是否变质的方法是___________ 。
(4)Z的浓溶液与碳单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(5)已知 能被
能被 氧化为Na2SO4,则240mL0.05mol/L的Na2SO3溶液与200mL0.02mol/L的
氧化为Na2SO4,则240mL0.05mol/L的Na2SO3溶液与200mL0.02mol/L的 溶液恰好完全反应时,Cr元素在还原产物中的化合价为
溶液恰好完全反应时,Cr元素在还原产物中的化合价为___________ 。
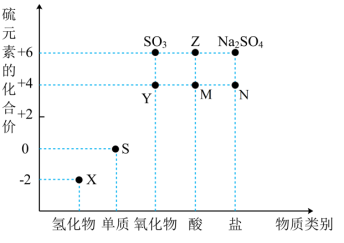
(2)将X与Y混合可生成淡黄色固体,该反应中还原剂与氧化剂的物质的量之比为
(3)检验N盐溶液是否变质的方法是
(4)Z的浓溶液与碳单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)已知
 能被
能被 氧化为Na2SO4,则240mL0.05mol/L的Na2SO3溶液与200mL0.02mol/L的
氧化为Na2SO4,则240mL0.05mol/L的Na2SO3溶液与200mL0.02mol/L的 溶液恰好完全反应时,Cr元素在还原产物中的化合价为
溶液恰好完全反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次



