名校
1 . SO2和NOx都是大气污染物。
(1)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是_______ 。
(2)汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是_______ 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:_______ ,NO2被吸收时,氧化剂和还原剂的物质的量之比为 _______ 。
工、农业废水以及生活污水中浓度较高的 ,会造成氮污染。工业上处理水体中
,会造成氮污染。工业上处理水体中 的一种方法是零价铁化学还原法。某小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(4)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。除锈反应的离子方程式是_______ 。
(5)将KNO3溶液的pH调至2.5,从氧化还原的角度分析调低溶液pH的原因是_______ 。已 知 :pH 越小表示溶液中c(H) 越大。
(6)将上述处理过的足量铁屑投入(5)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH 随时间变化的关系。
t1时刻前该反应的离子方程式是_______ 。
(1)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是
(2)汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:

工、农业废水以及生活污水中浓度较高的
 ,会造成氮污染。工业上处理水体中
,会造成氮污染。工业上处理水体中 的一种方法是零价铁化学还原法。某小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。(4)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。除锈反应的离子方程式是
(5)将KNO3溶液的pH调至2.5,从氧化还原的角度分析调低溶液pH的原因是
(6)将上述处理过的足量铁屑投入(5)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH 随时间变化的关系。
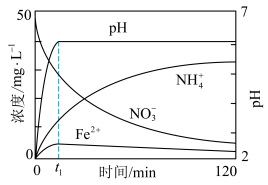
t1时刻前该反应的离子方程式是
您最近一年使用:0次
名校
2 . 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为___________ ;As的第一电离能比Se的第一电离能大的原因为___________ 。
(2) 中心原子的杂化类型是:
中心原子的杂化类型是:___________ , 的立体构型是
的立体构型是___________ 。
(3) 属于
属于___________ (填“极性”或“非极性”)分子;比较 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:___________ 。
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;若该晶胞密度为ρg⋅cm ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为___________ 。
(1)基态硒原子的价层电子排布式为
(2)
 中心原子的杂化类型是:
中心原子的杂化类型是: 的立体构型是
的立体构型是(3)
 属于
属于 与
与 沸点高低,并说明原因:
沸点高低,并说明原因:(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 ,硒化锌的摩尔质量为Mg⋅mol
,硒化锌的摩尔质量为Mg⋅mol ,
, 代表阿伏加德罗常数的值,则晶胞参数(边长)a为
代表阿伏加德罗常数的值,则晶胞参数(边长)a为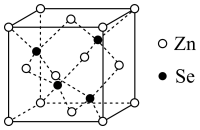
您最近一年使用:0次
2024-05-03更新
|
419次组卷
|
2卷引用:广东省茂名市高州中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
3 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和 ),其反应的化学方程式为
),其反应的化学方程式为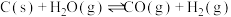 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
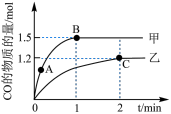
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示: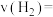
_______ 。
②甲容器中,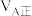
_______ 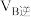 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。
③反应过程中,两个容器温度:甲_______ 乙。
(4)乙容器中C点时,CO的物质的量百分数为_______ 。
 ),其反应的化学方程式为
),其反应的化学方程式为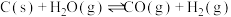 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是_______。

| A.铝粉与氧化铁的反应 | B.氯化铵与 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是_______。
| A.充入He使容器压强增大,提高反应速率 |
B.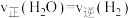 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为2L的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和2.8mol水蒸气,在不同温度下反应的过程如图所示:
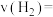
②甲容器中,
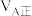
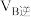 (填“<”“>”或“=”下同)。
(填“<”“>”或“=”下同)。③反应过程中,两个容器温度:甲
(4)乙容器中C点时,CO的物质的量百分数为
您最近一年使用:0次
2024-05-03更新
|
303次组卷
|
2卷引用:广东省东莞市东华高级中学2023-2024学年高一下学期前段考试化学试题
名校
解题方法
4 . 碳是一种非常神奇的元素,它有着像 、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题:
、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题: 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为___________ 。
(2)石墨属于___________ 晶体,24g的石墨中含有共价键的数目为___________ 。
(3)金刚石中碳原子数目与C-C键数目之比为___________ 。
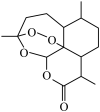
(4)青蒿素是从植物青蒿中提取的有机物,用于抗疟疾的药物。分子结构如图所示,则青蒿素分子中含有___________ 个手性碳原子。
 、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题:
、石墨和金刚石等这样结构和性质截然不同的单质,如下图所示,碳还是构成有机物的基本元素。请回答下列问题: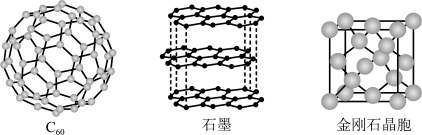
 、碳纳米管等都是碳元素的单质形式,它们互为
、碳纳米管等都是碳元素的单质形式,它们互为(2)石墨属于
(3)金刚石中碳原子数目与C-C键数目之比为
(4)青蒿素是从植物青蒿中提取的有机物,用于抗疟疾的药物。分子结构如图所示,则青蒿素分子中含有
您最近一年使用:0次
名校
5 . 人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
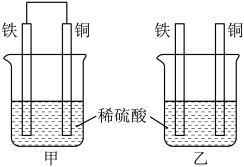
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:_____ 。
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中 均减小
均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_____ 乙(填“>”、“<”或“=”)。
③请写出甲、乙中构成原电池的正极电极反应式:_____ 。电池工作时,溶液中 向
向_____ 极(填“正”或“负”)移动。当甲中溶液质量增重27g时,电极上转移电子数目为_____ 。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_____ 。
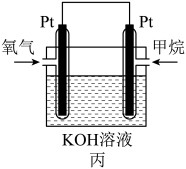
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的____ 极,电极反应为______ 。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_____。
A. 与 与 反应 反应 | B. 与 与 燃烧反应 燃烧反应 |
C.灼热的炭与 反应 反应 | D.氢氧化钠与稀盐酸反应 |
(2)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
A.甲中铜片质量减少、乙中铁片质量减少 B.甲、乙均为化学能转变为电能的装置
C.乙中铜片上没有明显变化 D.甲、乙两烧杯中
 均减小
均减小②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出甲、乙中构成原电池的正极电极反应式:
 向
向④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH.通甲烷一极是电池的
您最近一年使用:0次
6 . 配位化学的应用十分广泛,在经济、生产、生活等方面都有重要作用
(1) 在水溶液中以配离子
在水溶液中以配离子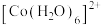 存在,在
存在,在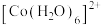 中配体是
中配体是______ ,配位原子是______ ;向含Co²⁺的水溶液中加入过量氨水可生成更稳定的 ,其原因是
,其原因是______ 。
(2)在碱性溶液中, 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。
(3)实验测得 蒸气以双聚分子(
蒸气以双聚分子(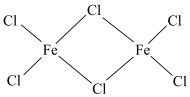 )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有______ (填字母)。
a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:______ ;B:______
(1)
 在水溶液中以配离子
在水溶液中以配离子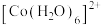 存在,在
存在,在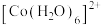 中配体是
中配体是 ,其原因是
,其原因是(2)在碱性溶液中,
 可以与缩二脲形成紫色配离子,其结构如图所示。
可以与缩二脲形成紫色配离子,其结构如图所示。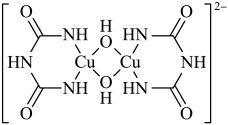
| A.该配离子与水分子可以形成氢键 |
| B.该配离子中铜离子的配位数是2 |
C.该配离子中 原子的杂化方式均是 原子的杂化方式均是 |
D.该配离子中非金属元素的电负性大小顺序为 |
(3)实验测得
 蒸气以双聚分子(
蒸气以双聚分子( )的形式存在,其中所含化学键类型有
)的形式存在,其中所含化学键类型有a.共价键 b.离子键 c.配位键
(4)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”{书写时用“[ ]”与外界分离}。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如
 与
与 形成的三种配合物A、B、C,
形成的三种配合物A、B、C, 的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
的配位数均为6,但它们的颜色各异,如果各取1molA、B、C溶于水,加入足量硝酸银溶液分别产生1mol、2mol、3mol白色沉淀。则A、B的化学式分别为A:
您最近一年使用:0次
解题方法
7 . 硅及其化合物在工业中有很多用处,一些硅的卤化物的熔点如表所示:
完成下列填空:
(1)硅原子核外电子共有______ 种形状不同的电子云,画出基态硅原子最外层电子的轨道表示式______ 。
(2)表中四种卤化物分子的空间结构均为______ ,由此推断 的键角为
的键角为______ , 属于
属于______ (填“极性”或“非极性”)分子。
(3)已知 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是______ ,表中四种卤化硅熔点存在差异的原因是______ 。
完成下列填空:
卤化物 |
|
|
|
|
熔点/℃ | -90.2 | 70.4 | 5.2 | 120.5 |
(1)硅原子核外电子共有
(2)表中四种卤化物分子的空间结构均为
 的键角为
的键角为 属于
属于(3)已知
 (熔点为-56.6℃)和
(熔点为-56.6℃)和 (熔点为1713℃)熔点相差较大;原因是
(熔点为1713℃)熔点相差较大;原因是
您最近一年使用:0次
解题方法
8 . 已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)写出X的元素符号:X______ 。
(2)基态Y原子价电子的电子排布式:______ 。
(3)W、X、Z三种元素的电负性由大到小的顺序是______ (填元素符号)。
(4) 和
和 的熔点更高的是
的熔点更高的是______ (填化学式),原因是:______ 。
(5)根据价层电子对互斥理论, 的空间构型为
的空间构型为______ , 中心原子的杂化方式为
中心原子的杂化方式为______ , 和
和 中键角较小的是
中键角较小的是______ (用离子符号表示)。
元素 | 元素性质或原子结构或离子结构 |
W | 原子核内无中子 |
X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
Y | 元素的原子半径在同周期中最大 |
Z | 基态原子核外有9种不同空间运动状态的电子,且有两个未成对电子 |
N |
|
(1)写出X的元素符号:X
(2)基态Y原子价电子的电子排布式:
(3)W、X、Z三种元素的电负性由大到小的顺序是
(4)
 和
和 的熔点更高的是
的熔点更高的是(5)根据价层电子对互斥理论,
 的空间构型为
的空间构型为 中心原子的杂化方式为
中心原子的杂化方式为 和
和 中键角较小的是
中键角较小的是
您最近一年使用:0次
9 . 能量以多种不同的形式存在,并能相互转化。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)氮元素在周期表的位置为_______ ,氨气的电子式为_______ 。
(2)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是_______ 。(填字母) ,放出
,放出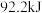 热量,已知断开
热量,已知断开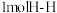 键、
键、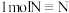 键分别需要吸收的能量为
键分别需要吸收的能量为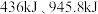 ,则
,则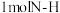 键断裂吸收的能量为
键断裂吸收的能量为______  (保留到小数点后一位)。
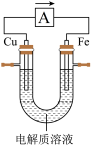
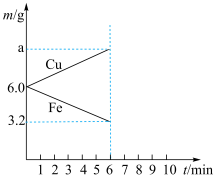
(保留到小数点后一位)。
Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前 和
和 电极质量相等。
电极质量相等。
(4)电解质为稀盐酸时,图中箭头的方向表示_______ (填“电子”或“电流”)的流向,铁棒上的电极反应式为_______ 。_______ 。
A.稀硫酸 B. 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液
② 时
时 电极的质量a为
电极的质量a为_______ g。
Ⅰ.合成氨反应在化工生产中具有重要意义。
(1)氮元素在周期表的位置为
(2)合成氨反应为放热反应,下列图示表示的过程也为放热反应的是
a.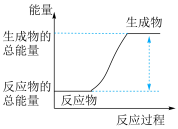 b.
b.  c.
c.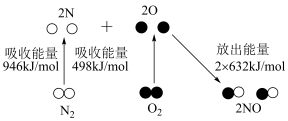
 ,放出
,放出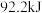 热量,已知断开
热量,已知断开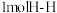 键、
键、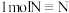 键分别需要吸收的能量为
键分别需要吸收的能量为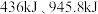 ,则
,则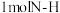 键断裂吸收的能量为
键断裂吸收的能量为 (保留到小数点后一位)。
(保留到小数点后一位)。Ⅱ.电池的发明是储能和供能技术的巨大进步,如图所示的原电池装置,插入电解质溶液前
 和
和 电极质量相等。
电极质量相等。(4)电解质为稀盐酸时,图中箭头的方向表示
A.稀硫酸 B.
 溶液 C.浓硝酸 D.
溶液 C.浓硝酸 D. 溶液
溶液②
 时
时 电极的质量a为
电极的质量a为
您最近一年使用:0次
名校
解题方法
10 . 硅、硫、氮等非金属元素在化工生产中扮演着重要角色。
(1)下列物品或设施:①陶瓷餐具②门窗玻璃③水晶镜片④硅太阳能电池⑤光导纤维⑥手机芯片。
直接使用了硅单质的是_______ (用序号填空)。
(2)写出实验室用Cu制备 的化学方程式:
的化学方程式:_______
(3)下列五种有色溶液与 作用均能褪色
作用均能褪色
①品红溶液②酸性 溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉-碘溶液
溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉-碘溶液
体现了 还原性的是(用序号填空)
还原性的是(用序号填空)_______ 。
(4)氮氧化物(NO、 )、
)、 会造成的环境问题有
会造成的环境问题有_______ (写一种即可)。
(5)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室制备并收集 ,制备原理为
,制备原理为_______ (用化学方程式表示);应选择的装置是_______ (填字母)。 的化学反应方程式:
的化学反应方程式:_______
(1)下列物品或设施:①陶瓷餐具②门窗玻璃③水晶镜片④硅太阳能电池⑤光导纤维⑥手机芯片。
直接使用了硅单质的是
(2)写出实验室用Cu制备
 的化学方程式:
的化学方程式:(3)下列五种有色溶液与
 作用均能褪色
作用均能褪色①品红溶液②酸性
 溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉-碘溶液
溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉-碘溶液体现了
 还原性的是(用序号填空)
还原性的是(用序号填空)(4)氮氧化物(NO、
 )、
)、 会造成的环境问题有
会造成的环境问题有(5)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室制备并收集
 ,制备原理为
,制备原理为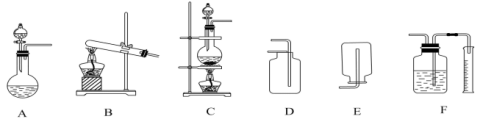
 的化学反应方程式:
的化学反应方程式:
您最近一年使用:0次
2024-04-28更新
|
232次组卷
|
2卷引用:广东省东莞市东华高级中学2023-2024学年高一下学期前段考试化学试题




 的M层全充满
的M层全充满

