名校
解题方法
1 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用,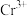 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为___________ ,同周期元素的基态原子最外层电子数与 相同的元素有
相同的元素有___________ (写元素符号)。
(2)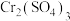 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为___________ ,基态 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为___________ 。
(3) 中
中 的数目为
的数目为___________ ,含有的的配体是___________ ,配位数是___________ ,配位原子是___________ 。
(4)比较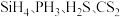 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:___________ 。
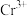 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态
 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为 相同的元素有
相同的元素有(2)
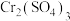 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为(3)
 中
中 的数目为
的数目为(4)比较
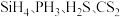 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:
您最近一年使用:0次
名校
2 . 根据原子核外电子排布规则,回答下列问题:
(1)写出基态 原子的简化核外电子排布式:
原子的简化核外电子排布式:___________ ;写出基态 原子的价层电子排布式:
原子的价层电子排布式:___________ 。
(2)写出基态 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:___________ 。
(3)若将基态 的电子排布式写成
的电子排布式写成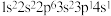 ,则它违背了
,则它违背了___________ 。
(4)已知 比
比 的稳定性更强,用电子排布解释其原因:
的稳定性更强,用电子排布解释其原因:___________ 。
(5)某基态原子的 能级中有一个电子,该原子为
能级中有一个电子,该原子为___________ (写元素符号)。
(1)写出基态
 原子的简化核外电子排布式:
原子的简化核外电子排布式: 原子的价层电子排布式:
原子的价层电子排布式:(2)写出基态
 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:(3)若将基态
 的电子排布式写成
的电子排布式写成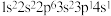 ,则它违背了
,则它违背了(4)已知
 比
比 的稳定性更强,用电子排布解释其原因:
的稳定性更强,用电子排布解释其原因:(5)某基态原子的
 能级中有一个电子,该原子为
能级中有一个电子,该原子为
您最近一年使用:0次
3 . Ⅰ.某些有机化合物的模型如图所示。回答下列问题:
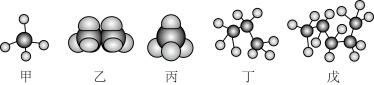
(1)属于填充模型的是___________ (填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是___________ 。
(3)存在同分异构体的是___________ ,请写出其任意一种同分异构体的结构简式___________ 。
Ⅱ.农药波尔多液的主要成分是CuSO4,下列两个反应都有CuSO4生成。
①Cu+2H2SO4=CuSO4+SO2+2H2O ②CuO+H2SO4=CuSO4+H2O
请回答下列问题:
(4)从分类角度来看CuSO4属于___________。
(5)上述两个反应属于氧化还原反应的是___________ (填序号),其中氧化剂是___________ 。
(6)反应①的副产物SO2是大气污染物,可用NaOH溶液吸收,反应方程式是___________ 。

(1)属于填充模型的是
(2)表示同一种有机化合物的是
(3)存在同分异构体的是
Ⅱ.农药波尔多液的主要成分是CuSO4,下列两个反应都有CuSO4生成。
①Cu+2H2SO4=CuSO4+SO2+2H2O ②CuO+H2SO4=CuSO4+H2O
请回答下列问题:
(4)从分类角度来看CuSO4属于___________。
| A.氧化物 | B.盐 | C.碱 | D.酸 |
(5)上述两个反应属于氧化还原反应的是
(6)反应①的副产物SO2是大气污染物,可用NaOH溶液吸收,反应方程式是
您最近一年使用:0次
名校
4 . I.请用下列10种物质的序号填空。
①N2 ②NH4Cl ③RbOH ④ ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气
(1)既含离子键又含共价键的是___________ ;只含共价键的的是___________ ;④的电子式为___________ ;⑦的空间构型为:___________ 。
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑭回答下列问题。
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:___________ (填元素符号)。
ii.能作为卤素非金属性递变规律的判断依据的是:___________ 。
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因___________ 。
(3)下列关于②~⑤元素叙述正确的是___________。
(4)③⑧⑩元素最高价氧化物对应的水化物之间可以两两发生反应,其中能体现水化物呈“两性”的离子方程式分别为___________ 、___________ 。
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是___________ (用化学式表示)。
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为___________ (用相应的离子符号排序)。
(7)用电子式表示①和⑦形成化合物的过程___________ ,该化合物与水反应的化学方程式是___________ 。
①N2 ②NH4Cl ③RbOH ④
 ⑤ KCl ⑥
⑤ KCl ⑥ ⑦
⑦ ⑧H2SO4 ⑨
⑧H2SO4 ⑨ ⑩氦气
⑩氦气(1)既含离子键又含共价键的是
II.下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
| 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ⑨ | ⑪ | |||||
| 3 | ③ | ⑥ | ⑧ | ⑩ | ⑫ | |||
| 4 | ④ | ⑦ | ⑬ | |||||
| 5 | ⑤ | ⑭ |
(2)i.⑪~⑭元素的非金属性由强到弱的顺序为:
ii.能作为卤素非金属性递变规律的判断依据的是:
A.⑪~⑭元素形成的单质熔点逐渐升高
B.⑪~⑭元素形成的简单离子还原性逐渐增强
C.⑪~⑭元素形成的气态氢化物稳定性逐渐减弱
D.⑪~⑭元素形成的无氧酸酸性逐渐增强
iii.从原子结构角度解释卤素非金属性递变的原因
(3)下列关于②~⑤元素叙述正确的是___________。
| A.从上到下②~⑤单质与水反应越来越剧烈 |
| B.②~⑤单质与氧气反应均可生成过氧化物 |
| C.从上到下②~⑤单质熔沸点逐渐升高 |
| D.②~⑤元素的最高价氧化物的水化物碱性增强 |
(5)上述元素形成的最高价氧化物的水化物中酸性最强的是
(6)元素④⑦⑩⑫对应的具有稳定结构的简单离子的半径由大到小的排序为
(7)用电子式表示①和⑦形成化合物的过程
您最近一年使用:0次
名校
解题方法
5 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。根据所学知识,回答下列问题:
(1)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为___________ 。
(2)食用加碘食盐能消除碘缺乏病的困扰,碘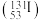 的质量数是
的质量数是___________ 。
(3)臭氧、“84”消毒液、二氧化氯、高铁酸钠等都是生活中常见的消毒剂。
①臭氧和氧气互为___________ (填“同位素”或“同素异形体”)。
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是___________ 。
③ 是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应
是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应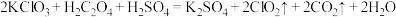 制得
制得 。该反应中产生
。该反应中产生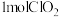 时,转移的电子的物质的量为
时,转移的电子的物质的量为___________ 。
④高铁酸钠 还是一种新型的净水剂。其净水过程中所发生的化学反应主要为
还是一种新型的净水剂。其净水过程中所发生的化学反应主要为 (胶体)
(胶体)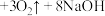 ,证明有
,证明有 胶体生成的实验操作为
胶体生成的实验操作为___________ 。
(4)汽车安全气囊弹出时发生反应: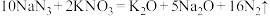 ,该反应中被氧化的N与被还原的N的物质的量之比为
,该反应中被氧化的N与被还原的N的物质的量之比为___________ 。
(5)铝制器具不宜盛放碱性食物,请写出铝与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(1)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为
(2)食用加碘食盐能消除碘缺乏病的困扰,碘
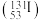 的质量数是
的质量数是(3)臭氧、“84”消毒液、二氧化氯、高铁酸钠等都是生活中常见的消毒剂。
①臭氧和氧气互为
②生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是
③
 是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应
是一种新型含氯消毒剂,在自来水消毒领域已经开始使用。实验室可通过反应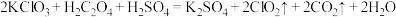 制得
制得 。该反应中产生
。该反应中产生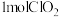 时,转移的电子的物质的量为
时,转移的电子的物质的量为④高铁酸钠
 还是一种新型的净水剂。其净水过程中所发生的化学反应主要为
还是一种新型的净水剂。其净水过程中所发生的化学反应主要为 (胶体)
(胶体)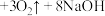 ,证明有
,证明有 胶体生成的实验操作为
胶体生成的实验操作为(4)汽车安全气囊弹出时发生反应:
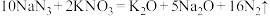 ,该反应中被氧化的N与被还原的N的物质的量之比为
,该反应中被氧化的N与被还原的N的物质的量之比为(5)铝制器具不宜盛放碱性食物,请写出铝与
 溶液反应的离子方程式:
溶液反应的离子方程式:
您最近一年使用:0次
名校
6 . I.为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)按下图中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。_______ (填字母)。
A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
(2)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_______。
Ⅱ.化学反应 的能量变化如图所示。
的能量变化如图所示。_______ (填“能”或“不能”)将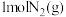 和
和 全部转化为
全部转化为 。
。
(4)该反应属于_______ (填“吸热”或“放热”)反应。
(5)一定量的 和
和 充分反应生成
充分反应生成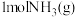 时,释放
时,释放_______  能量。
能量。
(1)按下图中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

A.甲中锌片是原电池的负极,乙中铜片是原电池的正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向

D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_______。
A.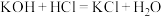 |
B.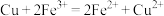 |
C. |
D.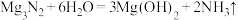 |
Ⅱ.化学反应
 的能量变化如图所示。
的能量变化如图所示。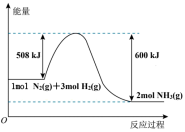
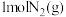 和
和 全部转化为
全部转化为 。
。(4)该反应属于
(5)一定量的
 和
和 充分反应生成
充分反应生成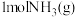 时,释放
时,释放 能量。
能量。
您最近一年使用:0次
名校
7 . I:我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时发生的反应为:S+2KNO3+3C=K2S+N2↑+3X↑请回答:
(1)X的化学式是___________ ,按照物质的组成和性质分类,属于___________ (填字母)。
A.单质 B.酸性氧化物 C.化合物 D.盐
(2)在上述反应中,氧化剂是(填化学式)___________ 。
II:如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用方程式2FeCl3 +Cu = CuCl2 + 2X表示。___________ 。
(4)在上述反应中,氧化剂为___________ ,氧化产物为___________ ,将两者的氧化性相比较,___________ 的氧化性更强。
(5)写出该反应的离子方程式,并用双线桥表示电子转移的方向和数目___________ 。
(1)X的化学式是
A.单质 B.酸性氧化物 C.化合物 D.盐
(2)在上述反应中,氧化剂是(填化学式)
II:如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用方程式2FeCl3 +Cu = CuCl2 + 2X表示。

(4)在上述反应中,氧化剂为
(5)写出该反应的离子方程式,并用双线桥表示电子转移的方向和数目
您最近一年使用:0次
名校
8 . 阅读下面一段材料并答问题。
高铁酸钾使用说明书
【化学式】 K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】
①干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。
②K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用。
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mg K2FeO4,即可达到卫生标准
(1)K2FeO4中铁元素的化合价为___________ 。
(2)制备K2FeO4需要在___________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠是一种新型的净水剂,可以通过下述反应制取:
2Fe(OH)3 +4NaOH+3NaClO=2Na2FeO4+3NaCl +5H2O
①该反应中的氧化剂是___________ ,___________ 元素被氧化,还原产物为___________ 。
②用单线桥法在化学方程式中标出电子转移的情况___________ 。
高铁酸钾使用说明书
【化学式】 K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】
①干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。
②K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用。
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mg K2FeO4,即可达到卫生标准
(1)K2FeO4中铁元素的化合价为
(2)制备K2FeO4需要在
(3)下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠是一种新型的净水剂,可以通过下述反应制取:
2Fe(OH)3 +4NaOH+3NaClO=2Na2FeO4+3NaCl +5H2O
①该反应中的氧化剂是
②用单线桥法在化学方程式中标出电子转移的情况
您最近一年使用:0次
名校
9 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
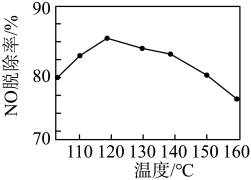
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近一年使用:0次
解题方法
10 . 硅材料在生活中占有重要地位。请回答:
(1) 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为___________ ,分子中氮原子的杂化轨道类型是___________ 。 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①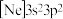 、②
、② 、③
、③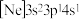 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(1)
 分子的空间结构(以
分子的空间结构(以 为中心)名称为
为中心)名称为 受热分解生成
受热分解生成 和
和 ,其受热不稳定的原因是
,其受热不稳定的原因是(2)由硅原子核形成的三种微粒,电子排布式分别为:①
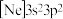 、②
、② 、③
、③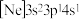 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>②>① | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次



