名校
1 . 白藜芦醇广泛存在于食物(如花生,尤其是葡萄)中,其结构简式为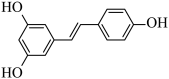 。根据要求回答下列问题:
。根据要求回答下列问题:
(1)白藜芦醇的分子式为_______ 。
(2)白藜芦醇分子中所含官能团的名称为_______ 。
(3)下列关于白藜芦醇的分类判断正确的是_______(填字母)。
(4)满足下列条件的白藜芦醇的同分异构体有_______ 种(仅考虑构造异构,不含本身),写出其中一种的结构简式_______ 。
①碳骨架和官能团种类不变;②两个苯环上都有含氧官能团。
(5)乙醇(CH3CH2OH)、苯酚(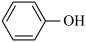 )和白藜芦醇中都含有官能团“-OH”,下列有关它们之间关系的说法正确的是_______(填字母)。
)和白藜芦醇中都含有官能团“-OH”,下列有关它们之间关系的说法正确的是_______(填字母)。
 。根据要求回答下列问题:
。根据要求回答下列问题:(1)白藜芦醇的分子式为
(2)白藜芦醇分子中所含官能团的名称为
(3)下列关于白藜芦醇的分类判断正确的是_______(填字母)。
| A.它属于链状烯烃 | B.它属于脂环化合物 |
| C.它属于芳香族化合物 | D.它属于烃的衍生物 |
①碳骨架和官能团种类不变;②两个苯环上都有含氧官能团。
(5)乙醇(CH3CH2OH)、苯酚(
 )和白藜芦醇中都含有官能团“-OH”,下列有关它们之间关系的说法正确的是_______(填字母)。
)和白藜芦醇中都含有官能团“-OH”,下列有关它们之间关系的说法正确的是_______(填字母)。| A.乙醇和白藜芦醇属于同一类别的有机物 |
| B.苯酚与白藜芦醇互为同系物 |
| C.三者的组成元素相同 |
| D.三者分子中碳、氧原子个数比相同 |
您最近一年使用:0次
2022-10-24更新
|
273次组卷
|
3卷引用:广东省江门市培英高级中学2022-2023学年高二下学期期中考试化学试题
2 . 维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图所示。请回答下列问题:

(1)以下关于维生素C的说法正确的是_______ (填字母)。
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是_______ (填字母)。
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为_______ 。
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是_______ ,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是_______ 。
(5)维生素C是一种易溶于水的有机物,主要原因是_______ 。

(1)以下关于维生素C的说法正确的是
a.分子中既含有极性键又含有非极性键
b.1 mol分子中含有2 mol π键和20 mol σ键
c.该物质的熔点可能高于NaCl
d.分子中碳原子的杂化方式有sp2和sp3两种
e.维生素C晶体溶于水的过程中要克服的微粒间作用力只有范德华力
(2)以下关于维生素C的说法正确的是
A.维生素C能使溴水或酸性高锰酸钾溶液褪色,且原理相同
B.维生素C在碱性溶液中能稳定存在
C.维生素C的分子式C6H8O6
D.1 mol维生素C与足量的钠反应能产生2 mol H2
E.分子中手性碳原子数目是2
(3)维生素C分子中含氧官能团的名称为
(4)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,K3[Fe(CN)6]中Fe3+的配体是
(5)维生素C是一种易溶于水的有机物,主要原因是
您最近一年使用:0次
名校
3 . 某实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
利用 和
和 (草酸)在酸性溶液中发生氧化还原反应来探究化学反应速率的影响因素(实验中所用
(草酸)在酸性溶液中发生氧化还原反应来探究化学反应速率的影响因素(实验中所用 溶液已加入稀硫酸酸化)
溶液已加入稀硫酸酸化)
(1)用离子方程式表示该反应的原理:_______
实验设计方案如下:
(2)该实验探究的是_______ 对化学反应速率的影响。褪色时间由小到大的顺序是_______ (填实验序号)。
(3)实验①测得 溶液的褪色时间为10min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为10min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率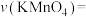
_______ 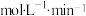 。
。
利用
 和
和 (草酸)在酸性溶液中发生氧化还原反应来探究化学反应速率的影响因素(实验中所用
(草酸)在酸性溶液中发生氧化还原反应来探究化学反应速率的影响因素(实验中所用 溶液已加入稀硫酸酸化)
溶液已加入稀硫酸酸化)(1)用离子方程式表示该反应的原理:
实验设计方案如下:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L  (aq) (aq) | 3mL 0.01mol/L  (aq) (aq) |
| ② | 2mL 0.2mol/L  (aq) (aq) | 3mL 0.01mol/ L  (aq) (aq) |
| ③ | 2mL 0.2mol/L  (aq) (aq) | 3mL 0.01mol/L  (aq)+ (aq)+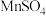 (少量) (少量) |
(3)实验①测得
 溶液的褪色时间为10min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为10min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率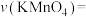
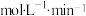 。
。
您最近一年使用:0次
名校
4 . 回答下列问题
(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如下表。
该温度下,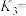
_______ (用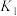 和
和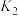 表示)。
表示)。
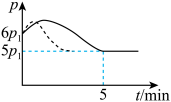
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04mol 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图实线所示,则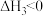 ,原因是
,原因是_______ ;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图I虚线所示,则改变的条件是_______ 。
(3)下图是甲、乙两同学描绘上述反应③的平衡常数的对数值(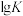 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是_______ (填“甲”或“乙”),a值为2,25℃时测得反应③在某时刻,NO(g)、 (g)、NOCl(g)的浓度分别为0.8mol/L、0.1mol/L、0.3mol/L,则此时
(g)、NOCl(g)的浓度分别为0.8mol/L、0.1mol/L、0.3mol/L,则此时
_______ 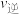 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。

(1)25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如下表。
| 热化学方程式 | 平衡常数 | |
| ① | 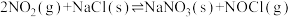 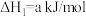 | 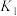 |
| ② | 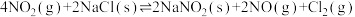 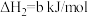 | 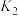 |
| ③ | 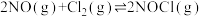 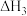 |  |
该温度下,
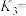
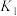 和
和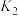 表示)。
表示)。(2)25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04mol
 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图实线所示,则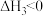 ,原因是
,原因是
(3)下图是甲、乙两同学描绘上述反应③的平衡常数的对数值(
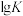 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是 (g)、NOCl(g)的浓度分别为0.8mol/L、0.1mol/L、0.3mol/L,则此时
(g)、NOCl(g)的浓度分别为0.8mol/L、0.1mol/L、0.3mol/L,则此时
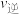 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
5 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有三种物质: 、
、 、
、
(1)其中氧元素的化合价均为___________ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为___________ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式___________ ,由此可推测 也可做供氧剂。
也可做供氧剂。
II、亚硝酸钠 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。
(6)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过150毫克,以此计算,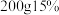 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠___________ 千克。
(7)亚硝酸钠在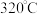 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目___________ 。

Ⅰ、有三种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① |  | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
(3)由
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。II、亚硝酸钠
 外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素
后可服用维生素 解毒。下列分析错误的是___________(填序号)。
解毒。下列分析错误的是___________(填序号)。A. 被还原 被还原 | B.维生素 具有还原性 具有还原性 |
C.还原性:维生素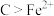 | D. 是还原剂 是还原剂 |
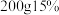 的亚硝酸钠溶液至少可用于生产火腿肠
的亚硝酸钠溶液至少可用于生产火腿肠(7)亚硝酸钠在
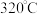 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式,并用双线桥法标出此反应的电子得失和数目
您最近一年使用:0次
2022-10-23更新
|
513次组卷
|
2卷引用:广东省中山市2022-2023学年高一上学期期中调研化学试题
名校
解题方法
6 . 1926年,我国化工专家侯德榜创造出的“侯氏制碱法”,结束了由美、英、法等国垄断世界纯碱市场的时代。其基本工业流程如图:

回答下列问题:
(1)上述物质中属于酸式盐的是___________ 。
(2)实验室用大理石和稀盐酸制备 ,请写出该反应的离子方程式
,请写出该反应的离子方程式___________ 。
(3)由碳酸氢钠制备纯碱的化学方程式为___________ 。
(4)氨气常用此反应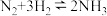 合成,请用单线桥法表示该反应的电子转移
合成,请用单线桥法表示该反应的电子转移___________ 。
(5)“侯氏制碱法”中除水外,能够循环利用的物质是___________ 和___________ (填化学式)。
(6)碳酸钠与氯化钠在外观上相似,请设计一个实验区分碳酸钠和氯化钠(写出实验操作和现象)___________ 。
(7)举例说明碳酸钠的两种工业用途:___________ 、___________ 。

回答下列问题:
(1)上述物质中属于酸式盐的是
(2)实验室用大理石和稀盐酸制备
 ,请写出该反应的离子方程式
,请写出该反应的离子方程式(3)由碳酸氢钠制备纯碱的化学方程式为
(4)氨气常用此反应
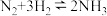 合成,请用单线桥法表示该反应的电子转移
合成,请用单线桥法表示该反应的电子转移(5)“侯氏制碱法”中除水外,能够循环利用的物质是
(6)碳酸钠与氯化钠在外观上相似,请设计一个实验区分碳酸钠和氯化钠(写出实验操作和现象)
(7)举例说明碳酸钠的两种工业用途:
您最近一年使用:0次
2022-10-23更新
|
426次组卷
|
2卷引用:广东省中山市2022-2023学年高一上学期期中调研化学试题
名校
7 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)提纯白磷样品(含惰性杂质)的流程如图1所示。过程I中,被还原的元素是_______ (填元素符号),过程III的化学方程式为_______ 。

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是一种十分具有商业潜力的电极材料,其制备流程如图2:
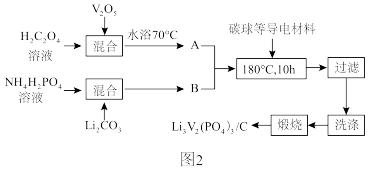
①A的主要成分为V2(C2O4)3,H2C2O4溶液与V2O5反应生成A的化学方程式为_______ 。
②流程中加入碳球的作用是_______ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。提纯工业级Li2CO3的实验方案是:将工业级Li2CO3与水混合,_______ ,得到LiHCO3溶液;控温加热使LiHCO3分解形成Li2CO3沉淀,再过滤、洗涤、干燥,得到Li2CO3纯品。“洗涤”时用乙醇而不用水的目的是_______ 。
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6。电池放电时,正极的电极反应式为_______ 。
(1)提纯白磷样品(含惰性杂质)的流程如图1所示。过程I中,被还原的元素是

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]是一种十分具有商业潜力的电极材料,其制备流程如图2:

①A的主要成分为V2(C2O4)3,H2C2O4溶液与V2O5反应生成A的化学方程式为
②流程中加入碳球的作用是
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。提纯工业级Li2CO3的实验方案是:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6。电池放电时,正极的电极反应式为
您最近一年使用:0次
2022-10-21更新
|
236次组卷
|
2卷引用:广东省广东实验中学2022-2023学年高三上学期第一次阶段考试化学试题
名校
8 . I.用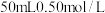 盐酸与
盐酸与 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______ ;由图可知此装置除了两烧杯没有填满碎泡沫塑料外,还有何不妥之处,应如何改正?_______ ;
(2)用相同浓度和体积的氨水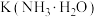 代替
代替 溶液进行上述实验,测得的中和反应反应热的数值会
溶液进行上述实验,测得的中和反应反应热的数值会_______ (填“偏大”、“偏小”、“无影响”)。
II.回答下列问题
(3)某些化学键的键能如表所示:
试回答下列问题:
已知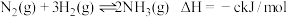 ,则
,则 键的键能是
键的键能是_______  (用含有a、b、c的式子表示)。
(用含有a、b、c的式子表示)。

(4)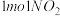 气体和
气体和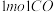 气体反应生成
气体反应生成 气体和
气体和 气体过程中的能量变化如图所示,请写出
气体过程中的能量变化如图所示,请写出 与
与 反应的热化学方程式:
反应的热化学方程式:_______ 。
(5)家用液化气的主要成分之一是丁烷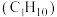 。常温常压条件下,
。常温常压条件下,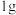 丁烷气体完全氧化生成
丁烷气体完全氧化生成 气体和液态水时放出热量
气体和液态水时放出热量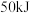 ,则表示丁烷
,则表示丁烷燃烧热 的热化学方程式为_______ 。
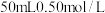 盐酸与
盐酸与 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)用相同浓度和体积的氨水
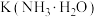 代替
代替 溶液进行上述实验,测得的中和反应反应热的数值会
溶液进行上述实验,测得的中和反应反应热的数值会II.回答下列问题
(3)某些化学键的键能如表所示:
| 化学键 |  |  |
键能/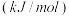 | a | b |
已知
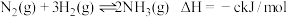 ,则
,则 键的键能是
键的键能是 (用含有a、b、c的式子表示)。
(用含有a、b、c的式子表示)。
(4)
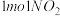 气体和
气体和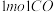 气体反应生成
气体反应生成 气体和
气体和 气体过程中的能量变化如图所示,请写出
气体过程中的能量变化如图所示,请写出 与
与 反应的热化学方程式:
反应的热化学方程式:(5)家用液化气的主要成分之一是丁烷
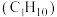 。常温常压条件下,
。常温常压条件下,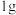 丁烷气体完全氧化生成
丁烷气体完全氧化生成 气体和液态水时放出热量
气体和液态水时放出热量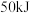 ,则表示丁烷
,则表示丁烷
您最近一年使用:0次
9 . 按要求回答下列问题:
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为___________ ;元素Mn与O中,第一电离能较大的是___________ ,基态原子核外未成对电子数较多的是___________ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为___________ 。
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。
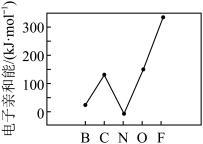
其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________ ,氮元素E1呈现异常的原因是___________ 。
(1)研究发现,在CO2低压合成甲醇反应CO2+3H2=CH3OH+H2O中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布为
(2)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl。
①氮原子的价层电子排布图为
②元素的基态的气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1),第二周期部分元素的E1变化趋势如图所示。

其中除氮元素外,其他元素的E1自左而右依次增大的原因是
您最近一年使用:0次
2022-10-20更新
|
211次组卷
|
10卷引用:广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题
广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题湖北省咸宁市嘉鱼县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)第一章 本章达标检测2河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题常州市武进区礼嘉中学2021-2022学年高二下学期第二次阶段测试化学试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题(已下线)第一章 原子结构与性质(B卷)
10 . 氨氯废水是造成水体富营养化的原因之一,其中氮元素多以 和
和 的形式存在。某工厂设计如下流程处理氨氯废水:
的形式存在。某工厂设计如下流程处理氨氯废水:
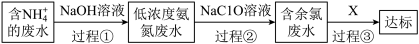
已知:余氯废水中含有未反应完的 ,不含氮元素;达标废水中氯元素以
,不含氮元素;达标废水中氯元素以 形式存在。
形式存在。
回答下列问题:
(1)检验达标废水中的 的操作及现象为
的操作及现象为_______ 。
(2)过程①的目的是将 转化为
转化为 ,并通过鼓入大量热空气将
,并通过鼓入大量热空气将 吹出。生成
吹出。生成 的离子方程式为
的离子方程式为_______ ;鼓入热空气能将 吹出的原因是
吹出的原因是_______ 。
(3)过程②加入 可将废水中的
可将废水中的 转化为无毒气体,反应方程式为:
转化为无毒气体,反应方程式为: ,请用双线桥分析该反应(要求在“桥”上标出:化合价升/降、得/失电子数,被氧化/还原)。
,请用双线桥分析该反应(要求在“桥”上标出:化合价升/降、得/失电子数,被氧化/还原)。____
(4)过程③中溶液X可能是_______ (填标号)。
a. 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液 d.
溶液 d. 溶液
溶液
 和
和 的形式存在。某工厂设计如下流程处理氨氯废水:
的形式存在。某工厂设计如下流程处理氨氯废水:
已知:余氯废水中含有未反应完的
 ,不含氮元素;达标废水中氯元素以
,不含氮元素;达标废水中氯元素以 形式存在。
形式存在。回答下列问题:
(1)检验达标废水中的
 的操作及现象为
的操作及现象为(2)过程①的目的是将
 转化为
转化为 ,并通过鼓入大量热空气将
,并通过鼓入大量热空气将 吹出。生成
吹出。生成 的离子方程式为
的离子方程式为 吹出的原因是
吹出的原因是(3)过程②加入
 可将废水中的
可将废水中的 转化为无毒气体,反应方程式为:
转化为无毒气体,反应方程式为: ,请用双线桥分析该反应(要求在“桥”上标出:化合价升/降、得/失电子数,被氧化/还原)。
,请用双线桥分析该反应(要求在“桥”上标出:化合价升/降、得/失电子数,被氧化/还原)。(4)过程③中溶液X可能是
a.
 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次



