1 . 回答下列问题:
(1)含有6.02×1023个H的H2O,其物质的量是_______ ;1molNa2SO4溶于水能电离出_______ 个Na+、_______ 个SO 。
。
(2)_______ molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为_______ 。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为_______ 。
(5)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为_______ ,该混合气体对氢气的相对密度为_______ 。
(6)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将ag该化合物加热至结晶水全部失去,剩余的残渣为bg,则n=_______ 。
(7)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为_______ 。
(1)含有6.02×1023个H的H2O,其物质的量是
 。
。(2)
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为
(5)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为
(6)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将ag该化合物加热至结晶水全部失去,剩余的残渣为bg,则n=
(7)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为
您最近一年使用:0次
2 . 回答下列问题:
(1)12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为_______ ,R的相对原子质量为_______ 。含R的质量为1.6g 的Na2R的物质的量为_______ 。
(2)质量之比为16:7:6的三种气体SO2、CO、NO,分子个数之比为_______ ;氧原子个数之比为_______ ;相同条件下的体积之比为_______ 。
(3)标准状况下,1.7g NH3体积为_______ L,它与标准状况下 _______ L H2S含有相同数目的氢原子。
(4)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______ ,R的相对原子质量为_______ 。
(1)12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为
(2)质量之比为16:7:6的三种气体SO2、CO、NO,分子个数之比为
(3)标准状况下,1.7g NH3体积为
(4)某气体氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
您最近一年使用:0次
3 . 回答下列问题:
(1)3.6 g H2O的物质的量是_______ ,含有水分子的数目是_______ ,含有氢原子的物质的量是_______ 。
(2)1.5molCO2和_______ g CH4在标准状况下占有相同的体积,其体积为_______ 。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量_______ 。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为_______ mol;一个X原子的质量为_______ g;该气体在标准状况下的体积为_______ L。
(5)200 mL Al2(SO4)3溶液中含Al3+ 5.4 g,则溶液中c(SO )=
)=_______ 。
(6)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=_______ 。(用含V、ρ的式子表示)
(1)3.6 g H2O的物质的量是
(2)1.5molCO2和
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为
(5)200 mL Al2(SO4)3溶液中含Al3+ 5.4 g,则溶液中c(SO
 )=
)=(6)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=
您最近一年使用:0次
4 . 计算
(1)3.01×1023个H2O的物质的量为_______ mol,其中,所含原子的物质的量为_______ mol,所含电子的物质的量为_______ mol。
(2)_______ g H2O中的氧原子数目与标准状况下22.4 LCO2中的氧原子数目相同。
(3)2g NaOH溶于水配制成_______ mL溶液时其物质的量浓度为2mol/L。
(4)在相同的条件下,等质量的N2、CO2、NH3的体积由大到小的顺序为_______ ,在相同条件下,等体积的N2、CO2、NH3的质量由大到小的顺序为_______ ,在相同条件下,等体积的N2、CO2、NH3密度由大到小的顺序为_______ 。
(5)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为_______
(6)电解1.8 g H2O所得的H2在标准状况下的体积为_______
(1)3.01×1023个H2O的物质的量为
(2)
(3)2g NaOH溶于水配制成
(4)在相同的条件下,等质量的N2、CO2、NH3的体积由大到小的顺序为
(5)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为
(6)电解1.8 g H2O所得的H2在标准状况下的体积为
您最近一年使用:0次
5 . 设NA表示阿伏加德罗常数的值,请回答下列问题:
(1)O2的摩尔质量为___________ g/mol,1molO2中含有___________ 个O2分子。
(2)6.02×1023个Na+约含有___________ molNa+,其质量为___________ g。
(3)0.5molCH4约含有___________ 个CH4分子,其标准状况的气体体积___________ L。
(4)0.2molO2与___________ molCH4原子数相等;质量相同的O3和O2物质的量之比为___________ 。
(5)0.2mol/LKCl溶液与___________ mol/LMgCl2溶液氯离子物质的量浓度相等,将这两种溶液按体积比1:2混合,不考虑混合时溶液体积变化,混合溶液中氯离子物质的量浓度为___________ 。
(1)O2的摩尔质量为
(2)6.02×1023个Na+约含有
(3)0.5molCH4约含有
(4)0.2molO2与
(5)0.2mol/LKCl溶液与
您最近一年使用:0次
名校
6 . 取10.6gNa2CO3溶于水配成100mL溶液,求:
(1)Na2CO3溶液的物质的量浓度_______ 。
(2)取出20.0mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求稀释后溶液的体积_______ 。
(3)取出20.0mL该溶液,向其中滴加足量1mol/L的稀硫酸,计算产生的CO2在标准状况下的体积_______ 。
(1)Na2CO3溶液的物质的量浓度
(2)取出20.0mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求稀释后溶液的体积
(3)取出20.0mL该溶液,向其中滴加足量1mol/L的稀硫酸,计算产生的CO2在标准状况下的体积
您最近一年使用:0次
名校
7 . 根据题意填空:
(1)3.01×1023个CO2分子的物质的量是_______ mol,在标准状况下其体积为_______ , 0.4molOH-的中有_______ 个电子。
(2)同温同压下,SO3与SO2的密度之比为_______ ;若体积相同时,两种气体的氧原子数之比为_______ 。
(3)19g某二价金属的氯化物ACl2中含有0.4mol氯离子,ACl2的摩尔质量是_______ ,该物质的化学式可能是_______ 。
(4)将标准状况下的VLHCl气体溶于1000 g水中,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为_______ 。
(1)3.01×1023个CO2分子的物质的量是
(2)同温同压下,SO3与SO2的密度之比为
(3)19g某二价金属的氯化物ACl2中含有0.4mol氯离子,ACl2的摩尔质量是
(4)将标准状况下的VLHCl气体溶于1000 g水中,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为
您最近一年使用:0次
8 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
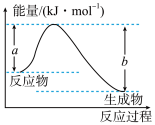
(1)如图表示某反应的能量变化关系,则此反应为___________ (填“吸收”或“放出”) ___________ kJ能量(用含有a、b的关系式表示)。
(2)反应H2(g)+ O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=___________ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为___________ 。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
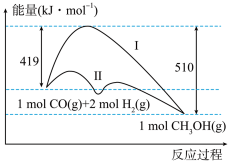
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是___________ kJ。
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是___________ (填“吸热”或“放热”)反应。
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。
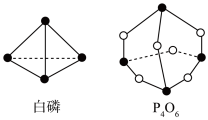
(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要___________ (“吸收或放出”)能量为___________ kJ
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |

(1)如图表示某反应的能量变化关系,则此反应为
(2)反应H2(g)+
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要
您最近一年使用:0次
解题方法
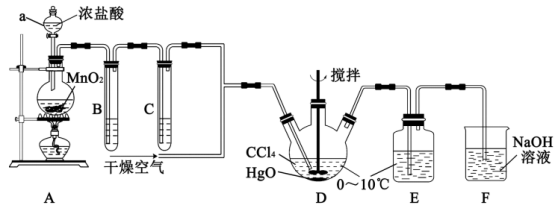
9 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为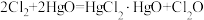 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:① 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②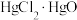 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片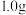 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入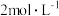 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知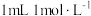 的硫代硫酸钠相当于
的硫代硫酸钠相当于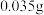 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为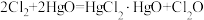 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
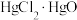 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
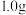 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入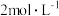 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知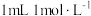 的硫代硫酸钠相当于
的硫代硫酸钠相当于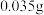 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
名校
解题方法
10 . 工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:
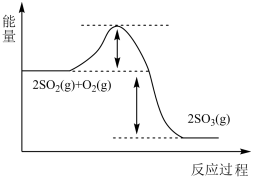
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为_______ (填“放热”或“吸热”)反应。
(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。
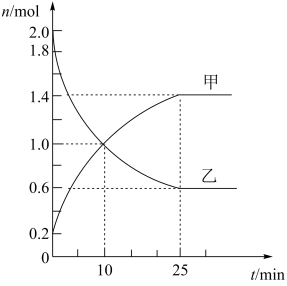
①甲为_______ (填化学式,下同),乙为_______ 。
②SO2与O2反应生成SO3的反应是_______ (填“可逆”或“不可逆”)反应。
③10 min时,v正(SO2)_______ (填“>”“<”或“=”)v逆(SO2)。
④从反应开始到平衡,反应速率v(SO3)_______ mol·L-1·min-1。
⑤反应达到平衡时,SO2的转化率为_______ 。
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为

(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①甲为
②SO2与O2反应生成SO3的反应是
③10 min时,v正(SO2)
④从反应开始到平衡,反应速率v(SO3)
⑤反应达到平衡时,SO2的转化率为
您最近一年使用:0次



