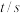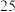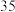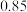名校
解题方法
1 . 将Fe2O3和Fe的混合物投入150 mL某浓度的稀硫酸中,收集到1.68 L H2(标准状况),同时Fe和Fe2O3均无剩余,且加入KSCN后溶液不显血红色,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,测得沉淀的质量为20.25 g,共消耗4 mol/L的NaOH溶液150 mL。(不考虑Fe(OH)2被氧化)
(1)原硫酸的物质的量浓度为_______ 。
(2)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=____ m(Fe)=_____ (无解题过程不给分)
(1)原硫酸的物质的量浓度为
(2)原混合物中Fe2O3和Fe的质量分别为多少m(Fe2O3)=
您最近一年使用:0次
解题方法
2 . (1)现有8种物质:① ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体 ⑥蔗糖溶液⑦
胶体 ⑥蔗糖溶液⑦ ⑧
⑧ 上述物质中属于电解质的有
上述物质中属于电解质的有_______ (选填序号);写出②的溶液与⑤反应的离子方程式_______
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: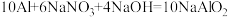
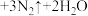 ,该反应中,还原剂为
,该反应中,还原剂为_______ ,若反应过程中转移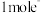 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为_______  。
。
(3)在含有一定量 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
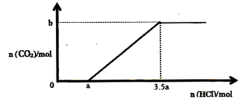
① 点发生反应的离子方程式为
点发生反应的离子方程式为_______
② 与
与 物质的量之比为
物质的量之比为_______
③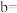
_______ (用含 的代数式表示)
的代数式表示)
(4)现有密度为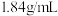 ,浓度为
,浓度为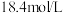 的浓硫酸,则该溶液中溶质的质量分数为
的浓硫酸,则该溶液中溶质的质量分数为_______
 ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤ 胶体 ⑥蔗糖溶液⑦
胶体 ⑥蔗糖溶液⑦ ⑧
⑧ 上述物质中属于电解质的有
上述物质中属于电解质的有(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 ,发生反应的化学方程式为:
,发生反应的化学方程式为: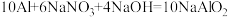
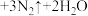 ,该反应中,还原剂为
,该反应中,还原剂为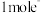 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为 。
。(3)在含有一定量
 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①
 点发生反应的离子方程式为
点发生反应的离子方程式为②
 与
与 物质的量之比为
物质的量之比为③
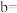
 的代数式表示)
的代数式表示)(4)现有密度为
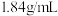 ,浓度为
,浓度为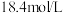 的浓硫酸,则该溶液中溶质的质量分数为
的浓硫酸,则该溶液中溶质的质量分数为
您最近一年使用:0次
3 . 甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______ 。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______ 。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正_____ v逆(填“>”“=”或“<”)。
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为_______ 。
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______ ,乙中CO2的转化率_______ (填“大于”、“等于”或“小于”)甲。
| 化学反应 | 平衡常数 | 温度/ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时v正
(4)某温度下在恒容密闭容器中发生反应①,若开始加入2mol/LH2和1mol/LCO,达到平衡时,H2的平衡转化率为80%,则此温度下,该反应的化学平衡常数为
(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为
| 起始浓度 | 甲 | 乙 |
| c(H2)/mol/L | 0.10 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.20 |
您最近一年使用:0次
4 . 一定温度下,向 恒容容器中充入
恒容容器中充入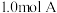 和
和 ,发生反应
,发生反应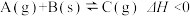 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
(1)前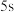 的平均反应速率
的平均反应速率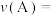
_______ ,达平衡时 的平衡体积分数为
的平衡体积分数为_______ 。
(2)由表中数据计算该温度下该反应的平衡常数为_______ ,随着反应温度升高,该反应的平衡常数_______ (选填“增大”、“减小”或“不变”)。
(3)保持温度不变,起始时向容器中充入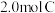 ,达平衡时,
,达平衡时, 的转化率为
的转化率为_______ 。
 恒容容器中充入
恒容容器中充入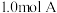 和
和 ,发生反应
,发生反应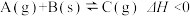 ,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
,经过一段时间后达到平衡。反应过程中测定的部分数据如表,回答下列问题:
|
|
|
|
|
|
 |
|
|
|
|
|
(1)前
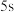 的平均反应速率
的平均反应速率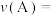
 的平衡体积分数为
的平衡体积分数为(2)由表中数据计算该温度下该反应的平衡常数为
(3)保持温度不变,起始时向容器中充入
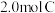 ,达平衡时,
,达平衡时, 的转化率为
的转化率为
您最近一年使用:0次
2021-02-03更新
|
212次组卷
|
2卷引用:四川省乐山市2020-2021学年高二上学期期末考试化学试题
解题方法
5 . 将过量Cu加入到100mL1mol/L稀HNO3中,充分反应。试计算(请写出必要的计算过程):
(1)标况下生成NO的体积_______ 。
(2)反应后溶液中c(Cu2+) [忽略溶液体积变化]_______ 。
(1)标况下生成NO的体积
(2)反应后溶液中c(Cu2+) [忽略溶液体积变化]
您最近一年使用:0次
6 . T0 ℃,向恒容密闭容器充入2 mol SO2和1 molO2发生反应: △H=-196.6 kJ/mol,达到平衡,生成1.6 mol SO3并放出热量157.28 kJ。
△H=-196.6 kJ/mol,达到平衡,生成1.6 mol SO3并放出热量157.28 kJ。
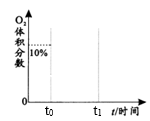
(1)平衡时SO2转化率为_______ ;t0时向上述平衡后的容器中再充入a mol SO2, 时重新达到平衡。请在图中用曲线表示出t0后O2的体积分数随时间变化的大致趋势
时重新达到平衡。请在图中用曲线表示出t0后O2的体积分数随时间变化的大致趋势_______ 。
(2)T0℃,向另一容积相等的恒压容器中充入2 mol SO2和1 mol O2,平衡时放出的热量_______ (填“>”、“<”或“=”) 157.28 kJ;若平衡时升高温度,平衡_______ 移动(填“正向”或“逆向”或“不”),该反应的平衡常数_______ (填“增大”或“减小”或“不变”);若测得T1℃平衡时该容器内气体压强为2 MPa,SO3体积分数为70%,计算该温度时反应的平衡常数Kp=_______  (列出计算式,以分压表示,分压=总压×物质的量分数。)
(列出计算式,以分压表示,分压=总压×物质的量分数。)
 △H=-196.6 kJ/mol,达到平衡,生成1.6 mol SO3并放出热量157.28 kJ。
△H=-196.6 kJ/mol,达到平衡,生成1.6 mol SO3并放出热量157.28 kJ。
(1)平衡时SO2转化率为
 时重新达到平衡。请在图中用曲线表示出t0后O2的体积分数随时间变化的大致趋势
时重新达到平衡。请在图中用曲线表示出t0后O2的体积分数随时间变化的大致趋势(2)T0℃,向另一容积相等的恒压容器中充入2 mol SO2和1 mol O2,平衡时放出的热量
 (列出计算式,以分压表示,分压=总压×物质的量分数。)
(列出计算式,以分压表示,分压=总压×物质的量分数。)
您最近一年使用:0次
解题方法
7 . 化学家研制出了一种复杂的铁氧化物(FexOy),取该氧化物76.0 g溶于600 mL 2.5 mol/L稀硫酸中,得到溶液X。向溶液X中加入一定体积4.0 mol/L NaOH溶液,恰好使溶液中的金属离子沉淀完全。过滤、洗涤,将沉淀加热至质量不再变化,得残渣80.0g。
回答下列问题:
(1)加热沉淀时发生反应的化学方程式为_______ ,所得残渣的颜色为_______ 。
(2)铁氧化物(FexOy)的化学式为_______ ,所加NaOH溶液的体积为_______ mL。
(3)向溶液X中加入足量铁粉制备绿矾(化学式为FeSO4·7H2O,相对分子质量278),不考虑产品损失,最多能够制备多少克绿矾?______ (无解题过程不给分)
回答下列问题:
(1)加热沉淀时发生反应的化学方程式为
(2)铁氧化物(FexOy)的化学式为
(3)向溶液X中加入足量铁粉制备绿矾(化学式为FeSO4·7H2O,相对分子质量278),不考虑产品损失,最多能够制备多少克绿矾?
您最近一年使用:0次
解题方法
8 . 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
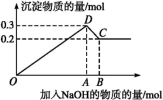
(1)写出下列线段内发生反应的离子方程式:OD段___________ , CD段___________ 。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为___________ 。
(3)图中C点表示时加入NaOH___________ mol。
(4)向C点对应溶液中通入足量CO2,写出反应的离子方程式___________ 。
(5)图中线段OA∶AB=___________ 。

(1)写出下列线段内发生反应的离子方程式:OD段
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为
(3)图中C点表示时加入NaOH
(4)向C点对应溶液中通入足量CO2,写出反应的离子方程式
(5)图中线段OA∶AB=
您最近一年使用:0次
解题方法
9 . (1)如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0g固体,配成1L溶液,请计算:
所得氢氧化钠溶液的物质的量浓度___________ ,从所得氢氧化钠溶液中取出200mL于一烧杯中,投入足量的金属铝,完全反应后,计算产生的气体在标准状况下的体积___________ 。
(2)Mg、Al混合物共0.4mol,用盐酸将其完全溶解,放出标准状况下11.2L气体,然后再滴入4mol/L的NaOH溶液,该混合物中Mg、Al的物质的量分别为___________ ;若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___________ 。
| 氢氧化钠化学纯(CP) 500g 品名:氢氧化钠 化学式:NaOH 相对分子质量:40 |
所得氢氧化钠溶液的物质的量浓度
(2)Mg、Al混合物共0.4mol,用盐酸将其完全溶解,放出标准状况下11.2L气体,然后再滴入4mol/L的NaOH溶液,该混合物中Mg、Al的物质的量分别为
您最近一年使用:0次
解题方法
10 . (1)质量为8gCH4气体分子数目为_______ ,在标准状况下的体积为_______ L;
(2)0.1mol某物质的质量为10.6g,则该物质的摩尔质量是_______ ;
(3)将53 g Na2CO3固体溶于水配成100 mL溶液,其密度为1.06g·mL-1,则该溶液中Na2CO3的物质的量浓度为_______ ,该溶液中Na2CO3的质量分数约为_______ 。
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为_______ ,产生的H2在标准状况下的体积为_______
(2)0.1mol某物质的质量为10.6g,则该物质的摩尔质量是
(3)将53 g Na2CO3固体溶于水配成100 mL溶液,其密度为1.06g·mL-1,则该溶液中Na2CO3的物质的量浓度为
(4)10.8gAl与100mLNaOH溶液恰好完全反应,溶液体积变化忽略不计,则该NaOH溶液的物质的量浓度为
您最近一年使用:0次