名校
1 . 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。现有一包铁粉和铜粉的混合粉末17.6g,使其完全溶解恰好需要200mL3.0mol/L的FeCl3溶液。假设溶液反应前后体积不变,试计算:(注意:无计算过程不给分)
(1)混合粉末中铜的质量___________ ;
(2)反应后溶液中FeCl2的物质的量浓度___________ 。
(1)混合粉末中铜的质量
(2)反应后溶液中FeCl2的物质的量浓度
您最近一年使用:0次
名校
解题方法
2 . 计算(要求写出计算过程)
(1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。
(2)已知在室温时,Mg(OH)2的溶度积Ksp=4.0×10-12(mol/L)3,求室温下Mg(OH)2饱和溶液中Mg2+和OH-的物质的量浓度。
(1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系。
(2)已知在室温时,Mg(OH)2的溶度积Ksp=4.0×10-12(mol/L)3,求室温下Mg(OH)2饱和溶液中Mg2+和OH-的物质的量浓度。
您最近一年使用:0次
名校
3 . 将5.92g固体试样xNa2CO3·yNaHCO3溶于水中,分成两等份,一份加入足量的Ba(OH)2溶液,充分反应后,静置过滤,得5.91g沉淀。另一份逐滴滴加1.0mol/L的稀盐酸,当滴加VmL盐酸时,产生的气体体积恰好达到最大值。求:
(1)该试样的组成为_______ ;
(2)V=_______ mL。
(1)该试样的组成为
(2)V=
您最近一年使用:0次
2021-06-26更新
|
616次组卷
|
3卷引用:四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题
名校
4 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
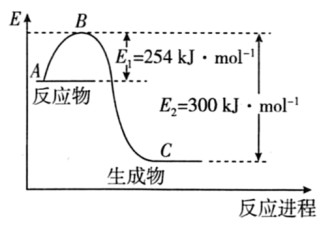
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
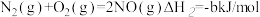 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: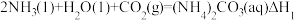
反应II: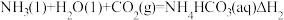
反应Ⅲ: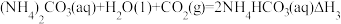
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①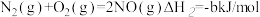 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
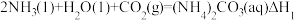
反应II:
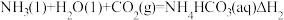
反应Ⅲ:
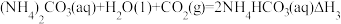
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1309次组卷
|
7卷引用:四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题
四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
解题方法
5 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______ mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______ mol/(L·min);
(3)化学反应方程式中x的值为_______ 。
(1)此时A的浓度c(A)=
(2)前5min内用B表示的平均反应速率v(B)=
(3)化学反应方程式中x的值为
您最近一年使用:0次
名校
6 . 把10.2g镁铝合金的粉末放入过量的烧碱中,得到6.72L标准状况下的H2,回答下列问题:
(1)写出铝与烧碱的反应的离子方程式_______
(2)列式计算:
①该合金中铝的质量_____ 。
②该合金溶于足量的盐酸溶液中,产生H2的体积____ (标准状况下)。
(1)写出铝与烧碱的反应的离子方程式
(2)列式计算:
①该合金中铝的质量
②该合金溶于足量的盐酸溶液中,产生H2的体积
您最近一年使用:0次
名校
解题方法
7 . (1)由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:_______ 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+ O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=_______ kJ/mol。氢气的燃烧热为_______ kJ/mol。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为_______ 。
 O2(g)=H2O(l)的ΔH=
O2(g)=H2O(l)的ΔH=(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol;则N2H4和NO2反应的热化学方程式为
您最近一年使用:0次
8 . 铜既能与稀硝酸反应,也能与浓硝酸反应,现将32 g Cu投入50 mL 12 mol/L的浓硝酸中,充分反应后,收集到4.48 L(标准状态)NO和NO2的混合气体。(Cu的相对原子质量为64)
(1)被还原硝酸的物质的量是_______ mol。
(2)反应后溶液中有_______ mol NO ,所以,剩余
,所以,剩余_______ (填反应物的化学式),其物质的量是_______ mol。
(3)如果往反应后的体系内再加入100 mL0.4 mol/L的稀硫酸,又会有气体逸出,离子反应方程式为_______ ,产生的气体在标准状况下的体积为_______ mL。
(1)被还原硝酸的物质的量是
(2)反应后溶液中有
 ,所以,剩余
,所以,剩余(3)如果往反应后的体系内再加入100 mL0.4 mol/L的稀硫酸,又会有气体逸出,离子反应方程式为
您最近一年使用:0次
名校
解题方法
9 . (1)反应3A(g)+B(g)=2C(g)在三种不同的条件下进行反应,一段时间后,测得的反应速率用不同的物质表示为:①vA=1mol/(L·min);②vC=0.5mol/(L·min);③vB=0.5mol/(L·min),则在三种不同条件下该反应速率由大到小的关系是___ (请用序号表示)。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
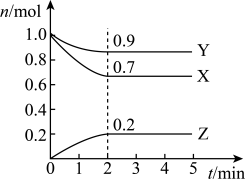
①该反应的化学方程式为___ 。
②反应开始至2min,以气体Z表示的平均反应速率为___ 。
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量___ (填“增大”、“减小”或“不变”,下同),混合气体密度比起始时___ 。
④上述反应,在第2min时,X的转化率为___ 。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②反应开始至2min,以气体Z表示的平均反应速率为
③若2min后反应达平衡,与初始时刻相比,此时容器内混合气体的平均相对分子质量
④上述反应,在第2min时,X的转化率为
您最近一年使用:0次
2021-06-02更新
|
384次组卷
|
6卷引用:四川省成都南开为明学校2019-2020学年高一下学期期中考试化学试题
名校
解题方法
10 . 恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值:_____ 。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量:_ 。
(3)原混合气体中,a∶b=_____ 。
(4)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=____ 。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值:
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量:
(3)原混合气体中,a∶b=
(4)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=
您最近一年使用:0次



