1 . 完成下列问题。
(1)写出下列物理量的单位:物质的量_______ ,摩尔质量_______ ,气体摩尔体积_______ ,物质的量浓度_______ 。
计算:
(2)标况下,11.2LNH3的物质的量是_______ mol,质量是_______ g。0.5molNa2SO4中含_______ 个Na+。
(3)1mol 中含有质子的物质的量为
中含有质子的物质的量为_______ mol,含有电子的物质的量为_______ mol。
(4)100mL2mol/L的硫酸溶液溶质的物质的量为_______ mol。
(1)写出下列物理量的单位:物质的量
计算:
(2)标况下,11.2LNH3的物质的量是
(3)1mol
 中含有质子的物质的量为
中含有质子的物质的量为(4)100mL2mol/L的硫酸溶液溶质的物质的量为
您最近一年使用:0次
名校
解题方法
2 . 现有含CuSO4和H2SO4的混合溶液249.8 g,向其中加入10%的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量关系如图所示:
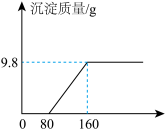
(1)产生的沉淀化学式是_______ 。
(2)计算恰好完全反应时,所得溶液的溶质质量分数_____ 。(结果保留一位小数)

(1)产生的沉淀化学式是
(2)计算恰好完全反应时,所得溶液的溶质质量分数
您最近一年使用:0次
3 . 将14g氧化钠和过氧化钠的混合物放入87.6g水中,得到100g溶液。求所得溶液中溶质的质量分数为是多少?___________
您最近一年使用:0次
解题方法
4 . 取58.85g由NaCl和Na2CO3组成的固体样品,加入足量稀盐酸完全反应,生成的气体在标准状况下体积为11.2L。回答下列问题:
(1)发生反应的离子方程式为_______ 。
(2)列式计算固体样品中Na2CO3和NaCl的物质的量之比_______ 。
(1)发生反应的离子方程式为
(2)列式计算固体样品中Na2CO3和NaCl的物质的量之比
您最近一年使用:0次
名校
解题方法
5 . 在某温度(T℃)的水溶液中,c(H+)=10xmol∙L-1,c(OH-)=10ymol∙L-1,x与y关系如图所示。
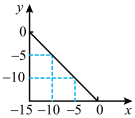
(1)该温度下,水的离子积为________ ,T℃_______ 25℃(填“>”“<”或“=”),纯水的pH________ 7(填“>”“<”或“=”)
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为________ 。(已知lg2=0.3)
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=_______ 。

(1)该温度下,水的离子积为
(2)将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(3)在此温度下,将pH=13的NaOH溶液VaL与pH=1的硫酸溶液VbL混合。若所得混合液的pH=2,则Va:Vb=
您最近一年使用:0次
名校
解题方法
6 . 将20.0 g铜镁合金完全溶解于140 mL某浓度的硝酸中,得到NO2和NO的混合气体8.96 L(标准状况),当向反应后的溶液中加入320 mL 4.0 mol/L NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为37 g。通过计算回答下列问题:
(1)该合金中铜与镁的物质的量之比是_______ 。
(2)该硝酸中HNO3的物质的量浓度是_______ mol/L。
(3)NO2和NO的混合气体中,NO2的体积分数是_______ 。
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为_______ L。
(1)该合金中铜与镁的物质的量之比是
(2)该硝酸中HNO3的物质的量浓度是
(3)NO2和NO的混合气体中,NO2的体积分数是
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为
您最近一年使用:0次
名校
解题方法
7 . 现有一定量(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,加热使之充分反应,直至Ba(OH)2溶液过量。图甲表示产生沉淀的质量与加入Ba(OH)2溶液的体积之间的关系,图乙表示放出NH3的体积(标准状况下)与加入Ba(OH)2溶液的体积之间的关系(假设NH3全部放出)。

(1)混合溶液中NH 的物质的量为
的物质的量为_____ mol。
(2)混合溶液中NO 的物质的量为
的物质的量为_____ mol。
(3)当加入的Ba(OH)2溶液的体积在100~200mL之间时,发生反应的离子方程式为______ 。
(4)若向原混合溶液中一次性加入同浓度的Ba(OH)2溶液200mL,则发生反应的离子方程式为______ 。

(1)混合溶液中NH
 的物质的量为
的物质的量为(2)混合溶液中NO
 的物质的量为
的物质的量为(3)当加入的Ba(OH)2溶液的体积在100~200mL之间时,发生反应的离子方程式为
(4)若向原混合溶液中一次性加入同浓度的Ba(OH)2溶液200mL,则发生反应的离子方程式为
您最近一年使用:0次
2023-04-03更新
|
263次组卷
|
2卷引用:四川省资阳市乐至中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
8 . 常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)已知 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是___________ (填序号)。
(2)Na2CO3溶液显碱性的原因___________ 。(用离子方程式表示)
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是_____ (填序号)。
(4)某温度下纯水的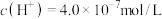 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使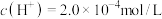 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
_______ 。
(5)25℃时, 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系_______ 。
(6)向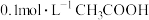 溶液中滴加
溶液中滴加 溶液至
溶液至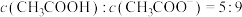 ,此时溶液
,此时溶液
_______ 。
(7)已知 的
的 ,
, 的
的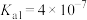 ,
,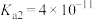 ,则反应
,则反应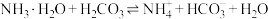 的平衡常数
的平衡常数
_______ 。
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ 性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
| 弱酸 |  |  |  |
| 电离平衡常数 |  |  | 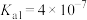 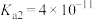 |
 溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;②
溶液呈中性。常温下,浓度均为0.1mol/L的8种溶液:①HCl溶液;② 溶液;③
溶液;③ 溶液:④NaOH;⑤
溶液:④NaOH;⑤ 溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧
溶液;⑥CH3COONa溶液;⑦KCl溶液:⑧ 溶液。这些溶液中水的电离程度最大是
溶液。这些溶液中水的电离程度最大是(2)Na2CO3溶液显碱性的原因
(3)若取等体积的pH=2的盐酸和醋酸两种溶液分别与足量金属锌反应,产生氢气的质量较多的是
(4)某温度下纯水的
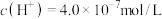 ,若温度不变,滴入稀盐酸,使
,若温度不变,滴入稀盐酸,使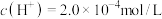 ,则此溶液中由水电离产生的
,则此溶液中由水电离产生的
(5)25℃时,
 的
的 的
的 溶液与
溶液与 的
的 的
的 溶液混合后,溶液呈中性,则a和b满足的关系
溶液混合后,溶液呈中性,则a和b满足的关系(6)向
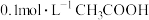 溶液中滴加
溶液中滴加 溶液至
溶液至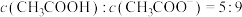 ,此时溶液
,此时溶液
(7)已知
 的
的 ,
, 的
的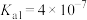 ,
,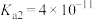 ,则反应
,则反应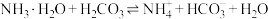 的平衡常数
的平衡常数
(8)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(9)25℃时,向0.1mol·L-1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是____。
A. | B. | C.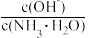 | D.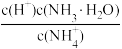 |
您最近一年使用:0次
解题方法
9 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
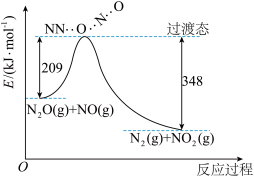
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次
名校
解题方法
10 . 用NaOH与 的混合物共28 g配制成100 mL溶液,测得该溶液中
的混合物共28 g配制成100 mL溶液,测得该溶液中 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
(1)原混合物中NaOH的质量分数______ %(保留一位小数)。
(2) 中的n值
中的n值______ 。
(3)盐酸的物质的量浓度______ 。
 的混合物共28 g配制成100 mL溶液,测得该溶液中
的混合物共28 g配制成100 mL溶液,测得该溶液中 。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:
。另取相同质量的上述混合物,加入盐酸完全反应后,放出的气体在标准状况下的体积为3.36 L,消耗盐酸200 mL。试计算:(1)原混合物中NaOH的质量分数
(2)
 中的n值
中的n值(3)盐酸的物质的量浓度
您最近一年使用:0次



