名校
解题方法
1 . a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
| A.1∶7 | B.8∶1 | C.7∶8 | D.7∶1 |
您最近一年使用:0次
名校
解题方法
2 . 二氧化氯(ClO2)是自来水常用的消毒剂。已知:ClO2常温下为黄绿色气体,易溶于水而不与水反应,11℃时液化成红棕色液体,在空气中的体积分数超过10%时有爆炸性,ClO2溶于碱溶液生成亚氯酸盐和氯酸盐。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。制取的装置如图所示(夹持装置已略去)。

(1)下列有关ClO2的说法不正确的是___________(填序号);
(2)冰水浴的作用是___________ 。
(3)在2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,每生成1molClO2,转移___________ mol电子。
(4)NaOH溶液中发生的主要反应的离子方程式为___________ 。
(5)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液,经检测,该溶液中还含有Cl-,写出生成ClO2的反应离子方程式:___________ 。
(6)在ClO2的制备方法中,有下列两种制备方法:
方法一:2KClO3+4HCl=2ClO2↑+Cl2↑+2KCl+2H2O
方法二:2KClO3+H2O2+H2SO4=2ClO2↑+K2SO4+O2↑+2H2O
用方法___________ 制备的ClO2更适合用于饮用水的消毒,其主要原因是___________ 。

(1)下列有关ClO2的说法不正确的是___________(填序号);
| A.ClO2与氯气从颜色上难以区分 |
| B.可以用向上排空气法收集,但不能用排水法收集 |
| C.属于酸性氧化物 |
| D.ClO2用于杀菌、消毒是因为它具有强氧化性 |
(2)冰水浴的作用是
(3)在2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O反应中,每生成1molClO2,转移
(4)NaOH溶液中发生的主要反应的离子方程式为
(5)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液,经检测,该溶液中还含有Cl-,写出生成ClO2的反应离子方程式:
(6)在ClO2的制备方法中,有下列两种制备方法:
方法一:2KClO3+4HCl=2ClO2↑+Cl2↑+2KCl+2H2O
方法二:2KClO3+H2O2+H2SO4=2ClO2↑+K2SO4+O2↑+2H2O
用方法
您最近一年使用:0次
名校
解题方法
3 . 把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。
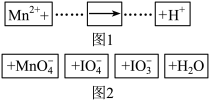
对该氧化还原反应的离子方程式,下列说法错误的是

对该氧化还原反应的离子方程式,下列说法错误的是
A.IO 作氧化剂,具有氧化性 作氧化剂,具有氧化性 | B.氧化剂和还原剂的物质的量之比为5:2 |
C.还原性:Mn2+> | D.若有2molMn2+参加反应,则转移14mol电子 |
您最近一年使用:0次
名校
解题方法
4 . 开发和利用海洋资源是当前科学研究的一项重要任务,如图是某化工厂对海洋资源综合利用的流程图:

请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:_______ 。
(2)初步提纯后的粗盐中含有 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
粗盐 滤液
滤液 精盐
精盐
加入的试剂①、②分别是:_______ 、_______ 。
(3)步骤③的条件是通直流电,其离子方程式为_______ 。D具有杀菌消毒的作用,在喷洒前需要在空气中晾置一会,这样做的原因是_______ 。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克( 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价)。则亚氯酸钠
价)。则亚氯酸钠 的有效氯含量为
的有效氯含量为_______ (保留两位小数)。
(5)若用来提取 ,反应⑤所用的氧化剂的来源较合理的是
,反应⑤所用的氧化剂的来源较合理的是_______ 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______ 性。对粗溴一般做如下处理:
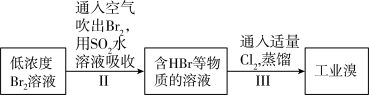
其中步骤II、III起到的作用是_______ 。
(7)某实验小组将一定量氯气通入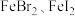 的混合溶液中,溶液中各种离子物质的量的变化如图所示,线段BC表示
的混合溶液中,溶液中各种离子物质的量的变化如图所示,线段BC表示_______ (填离子符号)物质的量的变化,原混合溶液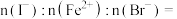
_______ 。


请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:
(2)初步提纯后的粗盐中含有
 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:粗盐
 滤液
滤液 精盐
精盐加入的试剂①、②分别是:
(3)步骤③的条件是通直流电,其离子方程式为
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克(
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价)。则亚氯酸钠
价)。则亚氯酸钠 的有效氯含量为
的有效氯含量为(5)若用来提取
 ,反应⑤所用的氧化剂的来源较合理的是
,反应⑤所用的氧化剂的来源较合理的是A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有

其中步骤II、III起到的作用是
(7)某实验小组将一定量氯气通入
 的混合溶液中,溶液中各种离子物质的量的变化如图所示,线段BC表示
的混合溶液中,溶液中各种离子物质的量的变化如图所示,线段BC表示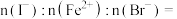

您最近一年使用:0次
名校
解题方法
5 . 二氧化氯(ClO2)是一种黄绿色气体,熔点为-59.5℃,沸点为11.0℃,易溶于水且不与冷水反应,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图所示:
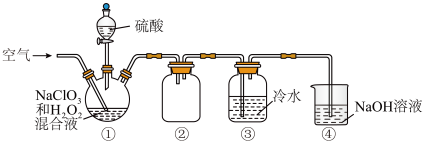
下列说法错误的是

下列说法错误的是
| A.实验中,通入空气的作用之一是稀释ClO2 |
| B.装置②作安全瓶,起防止倒吸的作用 |
| C.装置①反应中氧化剂与还原剂的物质的量之比为1:2 |
| D.当看到装置③中导管内液面上升时,应增大空气的通入速率 |
您最近一年使用:0次
2024-03-01更新
|
243次组卷
|
2卷引用:山东省淄博市2023-2024学年高一上学期期末考试化学试题
名校
解题方法
6 . 化学需氧量(Chemial Oxygen Demand)是在一定条件下,用强氧化剂氧化一定体积水中的还原性物质时所消耗氧化剂的量,折算成氧气的量(单位为mg/L)来表示。我国地表水可采用标准 法测定水中化学需氧量(COD),即水体中还原性物质每消耗
法测定水中化学需氧量(COD),即水体中还原性物质每消耗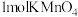 折算为
折算为 的消耗量。其操作步骤如下:
的消耗量。其操作步骤如下:
①取水样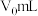 ,先加入足量稀硫酸酸化,再加入
,先加入足量稀硫酸酸化,再加入 的
的 标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。
标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。
②向①中溶液中加入 的
的 标准液(过量)。
标准液(过量)。
③用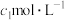 的
的 标准液滴定②中溶液至滴定终点,消耗
标准液滴定②中溶液至滴定终点,消耗 标准液
标准液 。
。
计算水样中COD含量(mg/L)表达式正确的是
 法测定水中化学需氧量(COD),即水体中还原性物质每消耗
法测定水中化学需氧量(COD),即水体中还原性物质每消耗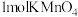 折算为
折算为 的消耗量。其操作步骤如下:
的消耗量。其操作步骤如下:①取水样
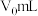 ,先加入足量稀硫酸酸化,再加入
,先加入足量稀硫酸酸化,再加入 的
的 标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。
标准液,煮沸30min(充分氧化水中的还原性物质),溶液呈稳定的红色,冷却至室温。②向①中溶液中加入
 的
的 标准液(过量)。
标准液(过量)。③用
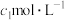 的
的 标准液滴定②中溶液至滴定终点,消耗
标准液滴定②中溶液至滴定终点,消耗 标准液
标准液 。
。计算水样中COD含量(mg/L)表达式正确的是
A. | B.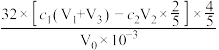 |
C.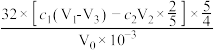 | D.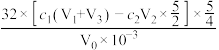 |
您最近一年使用:0次
7 . 利用碳氮化反应
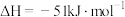 ,可将
,可将 转化为
转化为 ,再进一步还原得到金属钛,下列说法正确的是
,再进一步还原得到金属钛,下列说法正确的是

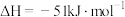 ,可将
,可将 转化为
转化为 ,再进一步还原得到金属钛,下列说法正确的是
,再进一步还原得到金属钛,下列说法正确的是| A.碳氯化反应在高温下不能自发进行 |
B.加压、降温均可增大生成 的速率 的速率 |
C.反应中每消耗 ,转移电子的数目约为 ,转移电子的数目约为 |
D.将 与 与 粉碎并混合均匀后反应可提高 粉碎并混合均匀后反应可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
名校
解题方法
8 . 已知反应 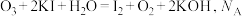 为阿伏加德罗常数的值,若生成
为阿伏加德罗常数的值,若生成  (标况),下列说法错误的是
(标况),下列说法错误的是
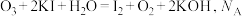 为阿伏加德罗常数的值,若生成
为阿伏加德罗常数的值,若生成  (标况),下列说法错误的是
(标况),下列说法错误的是A.转移的电子数目为  | B. 的 的 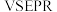 模型为 模型为  形 形 |
C.参与反应的  含有孤电子对数为 含有孤电子对数为 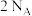 | D.生成的还原产物质量为  |
您最近一年使用:0次
名校
解题方法
9 . 研究小组制备次氯酸钠(NaClO)、探究其性质并测定其物质的量浓度。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为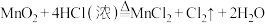 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为_________ 。
(2)B中饱和NaCl溶液的作用是________ 。
(3)C为NaClO制备装置,反应的离子方程式为_______ 。
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于________ ,可能与某些酸反应。小组同学将红色纸条浸入NaClO溶液后,纸条褪色,向溶液中通入 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成_______ (写化学式)。
(5)NaClO具有氧化性,预测依据是_______ 。小组同学向NaClO溶液中加入过量的KI溶液,加入适量稀硫酸,加入淀粉,溶液变蓝,无黄绿色气体产生。该反应的离子方程式为_______ 。
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制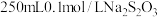 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。
(6)计算需要 固体的质量是
固体的质量是_____ g。
(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______ 。
(8)下列情况中,会使所配溶液浓度偏小的是___________ (填字母)。
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。
(9)计算NaClO溶液的物质的量浓度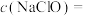
______ mol/L。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为
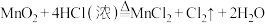 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为(2)B中饱和NaCl溶液的作用是
(3)C为NaClO制备装置,反应的离子方程式为
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于
 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成(5)NaClO具有氧化性,预测依据是
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制
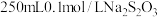 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。(6)计算需要
 固体的质量是
固体的质量是(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
(8)下列情况中,会使所配溶液浓度偏小的是
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用
 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。(9)计算NaClO溶液的物质的量浓度
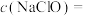
您最近一年使用:0次
23-24高一上·云南昆明·期末
名校
解题方法
10 . 氯气和二氧化氯是现代工业和生活中常用的杀菌消毒剂,实验室沿用舍勒的方法制取Cl2时所用仪器如图:

(1)实验室沿用舍勒的方法制取Cl2时选用图中装置___________ (填“A”或“B”),反应的离子方程式为___________ ,装置B中管f的作用是___________ 。
(2)实验室制取干燥、纯净的Cl2,所需如图装置的接口连接顺序为发生装置→_________ (填字母)。
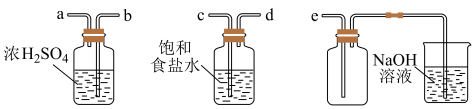
(3)化学实验中常用湿润的KI淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________ ,反应的化学方程式为___________ 。
(4)二氧化氯常温下为黄绿色或桔黄色气体,以下是二氧化氯的几种工业制备方法。
① 还原法:
还原法: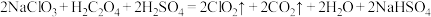 。还原产物为
。还原产物为_______ 。
② 还原法:
还原法: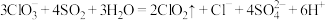 该反应中,氧化剂与还原剂的物质的量之比为
该反应中,氧化剂与还原剂的物质的量之比为_______ 。
③盐酸法: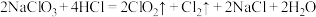 ;
;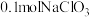 参加反应,作酸性介质的
参加反应,作酸性介质的 的物质的量为
的物质的量为______  。
。
④ 自氧化法:
自氧化法: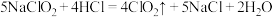 ;
;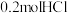 参加反应,转移的电子数为
参加反应,转移的电子数为_______ 。
⑤Solvey法: 在酸性条件下将
在酸性条件下将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。

(1)实验室沿用舍勒的方法制取Cl2时选用图中装置
(2)实验室制取干燥、纯净的Cl2,所需如图装置的接口连接顺序为发生装置→

(3)化学实验中常用湿润的KI淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到
(4)二氧化氯常温下为黄绿色或桔黄色气体,以下是二氧化氯的几种工业制备方法。
①
 还原法:
还原法: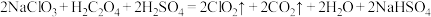 。还原产物为
。还原产物为②
 还原法:
还原法: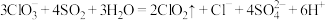 该反应中,氧化剂与还原剂的物质的量之比为
该反应中,氧化剂与还原剂的物质的量之比为③盐酸法:
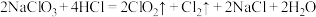 ;
;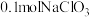 参加反应,作酸性介质的
参加反应,作酸性介质的 的物质的量为
的物质的量为 。
。④
 自氧化法:
自氧化法: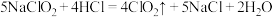 ;
;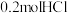 参加反应,转移的电子数为
参加反应,转移的电子数为⑤Solvey法:
 在酸性条件下将
在酸性条件下将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次



