1 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.将2mol NO和2mol  混合,充分反应后体系中原子总数为8 混合,充分反应后体系中原子总数为8 |
B.标准状况下,22.4L  中所含原子数为4 中所含原子数为4 |
C.1mol的铁与足量的硫粉发生反应,转移的电子数为3 |
D.100g质量分数为9.8%的 水溶液中所含氧原子数目为0.4 水溶液中所含氧原子数目为0.4 |
您最近半年使用:0次
2 . 已知反应 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是
 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是A.转移的电子数目为 |
B. 是由非极性共价键形成的非极性分子 是由非极性共价键形成的非极性分子 |
C.参与反应的 含有孤电子对数为 含有孤电子对数为 |
| D.生成的还原产物质量为56g |
您最近半年使用:0次
解题方法
3 . 根据元素的特征完成下列问题。
I.元素A、B、J、D、E、F、G是元素周期表前四周期的常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)在下列物质中属于离子化合物的是有___________ ,仅含共价键的有___________ 。
①AF ②DF ③ ④
④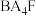
(2)E的单质与D的最高价氧化物对应水化物溶液反应的离子方程式为___________ 。
(3)B原子能与碳原子形成化学式为 的链状分子,其中所有原子都满足8电子稳定结构。
的链状分子,其中所有原子都满足8电子稳定结构。 的电子式为
的电子式为___________ 。
(4)在X中,G元素基态离子的价层电子的轨道排布式为___________ 。
Ⅱ.几种短周期元素的原子结构和性质如下所示:
(5)元素②的离子结构示意图为___________ 。
(6)元素⑦的简单氢化物与少量⑤的单质反应时,观察到有大量白烟产生,同时得到氮气。该反应中,氧化剂与还原剂的物质的量之比为___________ 。
(7)元素①和③的单质相互反应得到产物Y。用电子式表示Y 形成过程为___________ 。
I.元素A、B、J、D、E、F、G是元素周期表前四周期的常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
| A | 原子核外电子只有一种运动状态 |
| B | 简单离子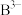 与D的离子具有相同电子排布 与D的离子具有相同电子排布 |
| J | 基态原子中s电子总数与p电子总数相等 |
| D | 元素的焰色试验呈黄色 |
| E | 基态原子价层电子排布式为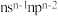 |
| F | 在基态原子的最外层上,p轨道有2个电子的自旋状态与其他电子相反 |
| G | 生活中使用最多的一种金属,其某种盐X溶液常用于刻蚀铜制印刷电路 |
①AF ②DF ③
 ④
④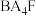
(2)E的单质与D的最高价氧化物对应水化物溶液反应的离子方程式为
(3)B原子能与碳原子形成化学式为
 的链状分子,其中所有原子都满足8电子稳定结构。
的链状分子,其中所有原子都满足8电子稳定结构。 的电子式为
的电子式为(4)在X中,G元素基态离子的价层电子的轨道排布式为
Ⅱ.几种短周期元素的原子结构和性质如下所示:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 最外层电子数 | 6 | 1 | 1 | ||||
| 原子半径/nm | 0.074 | 0.16 | 0.152 | 0.11 | 0.099 | 0.186 | 0.075 |
| 主要化合价 | +2 | -3,+5 | -1,+7 | -3,+5 |
(6)元素⑦的简单氢化物与少量⑤的单质反应时,观察到有大量白烟产生,同时得到氮气。该反应中,氧化剂与还原剂的物质的量之比为
(7)元素①和③的单质相互反应得到产物Y。用电子式表示Y 形成过程为
您最近半年使用:0次
4 . 某化学兴趣小组利用KBr废液制备溴单质,其流程如图所示(“氧化1”时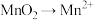 )。下列说法正确的是
)。下列说法正确的是
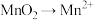 )。下列说法正确的是
)。下列说法正确的是
| A.“吹出”时涉及氧化还原反应 |
| B.可用乙醇从溴水中萃取溴 |
C.“氧化1”时若1 mol 发生反应,则转移4 mol电子 发生反应,则转移4 mol电子 |
D.“氧化2”时发生反应 |
您最近半年使用:0次
名校
5 . 黄铁矿催化氧化的化学反应为 。设
。设 为阿伏加德罗常数的值,下列有关该反应的说法正确的是
为阿伏加德罗常数的值,下列有关该反应的说法正确的是
 。设
。设 为阿伏加德罗常数的值,下列有关该反应的说法正确的是
为阿伏加德罗常数的值,下列有关该反应的说法正确的是A.36 gH2O中含有中子的数目为 |
B.每生成5.6 g  转移电子的数目为 转移电子的数目为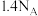 |
C.11.2 L H2中含有非极性键的数目为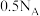 |
D.500 mL 0.1 mol⋅L  溶液中含有 溶液中含有 数目为 数目为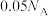 |
您最近半年使用:0次
6 . 若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,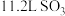 含有的分子数为 含有的分子数为 |
B.32g Cu在足量硫蒸气中完全反应失去的电子数为 |
C.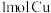 和含有 和含有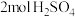 的浓硫酸反应,生成的 的浓硫酸反应,生成的 分子数目为 分子数目为 |
D.常温下,5.6g铁与硝酸反应,失去的电子数一定为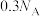 |
您最近半年使用:0次
7 . 硅单质及其化合物应用广泛。请回答下列问题:
(1)传统的无机非金属材料多为硅酸盐材料,主要包括________ 、水泥和玻璃。
(2) 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是________ (用化学方程式表示)。
(3)沙子可用作建筑材料和制玻璃的原料,下列说法不正确的是________(填字母)。
(4)硅单质可作为硅半导体材料。三氯甲硅烷( )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:________ 。
②整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式________ ;在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是________ 。
(5)新型陶瓷材料氮化硅( )可应用于原子反应堆,一种制备氮化硅的反应如下:
)可应用于原子反应堆,一种制备氮化硅的反应如下: 。若生成标准状况下33.6LCO时,反应过程中转移的电子数为
。若生成标准状况下33.6LCO时,反应过程中转移的电子数为________  。
。
(1)传统的无机非金属材料多为硅酸盐材料,主要包括
(2)
 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(3)沙子可用作建筑材料和制玻璃的原料,下列说法不正确的是________(填字母)。
A. 能与水反应 能与水反应 | B. 在一定条件下能与氧化钙反应 在一定条件下能与氧化钙反应 |
C. 是制作光导纤维的主要原料 是制作光导纤维的主要原料 | D. 能与稀硫酸反应 能与稀硫酸反应 |
(4)硅单质可作为硅半导体材料。三氯甲硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图: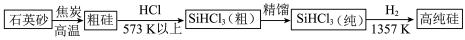
②整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式 ,可能引起的后果是
,可能引起的后果是(5)新型陶瓷材料氮化硅(
 )可应用于原子反应堆,一种制备氮化硅的反应如下:
)可应用于原子反应堆,一种制备氮化硅的反应如下: 。若生成标准状况下33.6LCO时,反应过程中转移的电子数为
。若生成标准状况下33.6LCO时,反应过程中转移的电子数为 。
。
您最近半年使用:0次
8 . 实验室用磷矿脱镁废液制备 的实验过程可表示为
的实验过程可表示为 及少量
及少量 、
、 、
、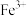 、
、 和
和 。
。
①向废液中加入 溶液调节
溶液调节 为
为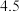 ,可达到
,可达到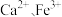 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为_________ 。
②将除杂净化后的清液控制在一定温度,加入 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是_______ 。 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是_______ 。
(2)实验室用如下方案测定 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取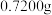 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成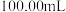 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用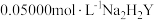 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗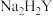 标准液
标准液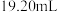 。计算该产品中
。计算该产品中 的纯度
的纯度_______ (写出计算过程)。
(3)恒温转化后的母液中主要含 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下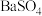 、
、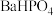 的溶度积常数依次为
的溶度积常数依次为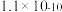 和
和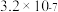 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中_______ ,过滤、用无水乙醇洗涤,干燥。
 的实验过程可表示为
的实验过程可表示为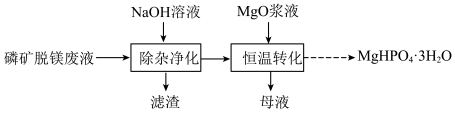
 及少量
及少量 、
、 、
、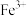 、
、 和
和 。
。①向废液中加入
 溶液调节
溶液调节 为
为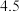 ,可达到
,可达到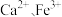 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为②将除杂净化后的清液控制在一定温度,加入
 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是
 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是(2)实验室用如下方案测定
 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取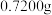 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成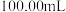 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用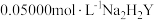 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗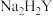 标准液
标准液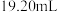 。计算该产品中
。计算该产品中 的纯度
的纯度(3)恒温转化后的母液中主要含
 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下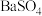 、
、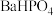 的溶度积常数依次为
的溶度积常数依次为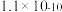 和
和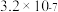 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中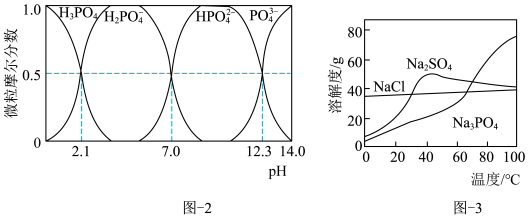
您最近半年使用:0次
名校
解题方法
9 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为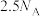 |
B.断裂的 键数为 键数为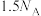 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近半年使用:0次
名校
10 . PtNiFe—LDHGO催化甲醛氧化的反应机理如图:
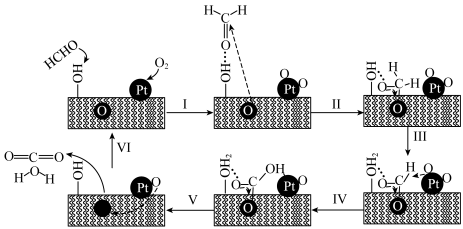
A.步骤Ⅰ中甲醛通过氢键吸附在催化剂表面的 上 上 |
| B.上述反应机理涉及极性键和非极性键的形成 |
C.该反应每生成1 mol ,转移电子的数目约为 ,转移电子的数目约为 |
| D.PtNiFe—LDHGO降低了该反应的活化能 |
您最近半年使用:0次



