名校
1 . I.金属镓( )应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。 是共价化合物,一种重要的半导体材料。
是共价化合物,一种重要的半导体材料。 与
与 同周期,
同周期, 与
与 同主族。
同主族。
(1)下列事实不能用元素周期律解释的是_______ (填字母)。
a.碱性: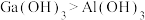 b.非金属性:
b.非金属性:
c.酸性: d.氢化物的还原性:
d.氢化物的还原性:
(2)废弃含 半导体材料可以用浓硝酸溶解
半导体材料可以用浓硝酸溶解 ,生成
,生成 和
和 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
II. 、
、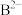 、
、 、
、 、
、 、
、 分别表示含10个电子的六种粒子。其中:
分别表示含10个电子的六种粒子。其中:
a. 、
、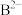 、
、 核外电子层结构相同
核外电子层结构相同
b. 是由两种元素组成的
是由两种元素组成的
c. 是两种元素组成的四原子分子
是两种元素组成的四原子分子
d. 在常温下是无色液体
在常温下是无色液体
e.往含 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后白色沉淀消失
的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(3)电子式表示 的形成过程
的形成过程_______ 。
(4)含 的溶液中通入过量D,反应的离子方程式是
的溶液中通入过量D,反应的离子方程式是_______ 。
(5)A单质与E反应的生成的化合物中化学键的类型是_______ 。
 )应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。 是共价化合物,一种重要的半导体材料。
是共价化合物,一种重要的半导体材料。 与
与 同周期,
同周期, 与
与 同主族。
同主族。(1)下列事实不能用元素周期律解释的是
a.碱性:
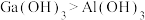 b.非金属性:
b.非金属性:
c.酸性:
 d.氢化物的还原性:
d.氢化物的还原性:
(2)废弃含
 半导体材料可以用浓硝酸溶解
半导体材料可以用浓硝酸溶解 ,生成
,生成 和
和 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式II.
 、
、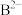 、
、 、
、 、
、 、
、 分别表示含10个电子的六种粒子。其中:
分别表示含10个电子的六种粒子。其中:a.
 、
、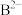 、
、 核外电子层结构相同
核外电子层结构相同 b.
 是由两种元素组成的
是由两种元素组成的c.
 是两种元素组成的四原子分子
是两种元素组成的四原子分子 d.
 在常温下是无色液体
在常温下是无色液体e.往含
 的溶液中滴加含
的溶液中滴加含 的溶液至过量,先有白色沉淀生成,后白色沉淀消失
的溶液至过量,先有白色沉淀生成,后白色沉淀消失(3)电子式表示
 的形成过程
的形成过程(4)含
 的溶液中通入过量D,反应的离子方程式是
的溶液中通入过量D,反应的离子方程式是(5)A单质与E反应的生成的化合物中化学键的类型是
您最近一年使用:0次
名校
解题方法
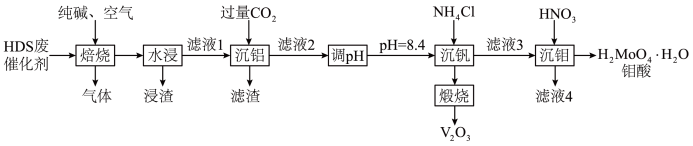
2 . 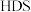 催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从
催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从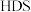 废催化剂(主要成分为
废催化剂(主要成分为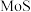 、
、 、
、 、
、 等)中提取贵重金属钒和钼,其工艺流程如图所示。
等)中提取贵重金属钒和钼,其工艺流程如图所示。
已知:Ⅰ.焙烧时 、
、 、
、 均可与纯碱反应生成对应的钠盐,而
均可与纯碱反应生成对应的钠盐,而 不行。
不行。
Ⅱ.高温下 易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
Ⅲ.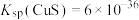 ;
; 、
、 。
。
请回答下列问题:
(1)请写出“焙烧”过程中
 ,及
,及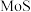 分别与纯碱反应的化学方程式:
分别与纯碱反应的化学方程式:(2)“浸渣”的成分为
 外,还含有
外,还含有(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始
 的加入量为
的加入量为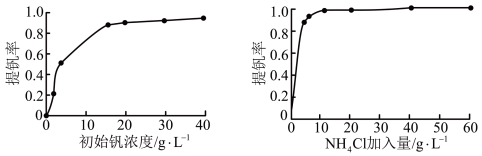
(4)在实际工业生产中,“沉钼”前要加入
 完全沉淀掉溶液中的
完全沉淀掉溶液中的 ,应维持反应后溶液中
,应维持反应后溶液中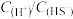 的范围是
的范围是(5)“沉钒”时生成
 沉淀,请写出“煅烧”中发生反应的化学方程式:
沉淀,请写出“煅烧”中发生反应的化学方程式:
您最近一年使用:0次
名校
3 . 物质类别和元素化合价是研究物质性质的两个重要角度。
Ⅰ.硫在不同价态之间的转化: 溶液
溶液 溶液
溶液
(1)反应①的转化说明
 的类别属于
的类别属于 溶液,从化合价的角度分析,反应②合理的是
溶液,从化合价的角度分析,反应②合理的是a. b.
b. c.
c.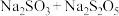
Ⅱ.某兴趣小组模拟工业制取 的装置(夹持和加热装置略)如图所示。
的装置(夹持和加热装置略)如图所示。
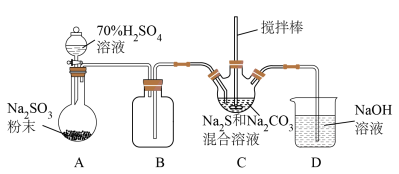
(2)装置A中发生反应的化学方程式为
(3)装置C发生的反应有①
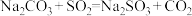 ;②……;③
;②……;③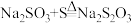 ,反应②的离子方程式为
,反应②的离子方程式为 ,应使三颈烧瓶中
,应使三颈烧瓶中 和
和 恰好完全反应,则三颈烧瓶中
恰好完全反应,则三颈烧瓶中 和
和 物质的量之比应为
物质的量之比应为(4)工业上常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 ,发生反应的离子方程式为
,发生反应的离子方程式为 可用于氰化物解毒,解毒原理为
可用于氰化物解毒,解毒原理为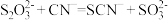 。体外模拟该解毒实验,检验该转化有
。体外模拟该解毒实验,检验该转化有 生成的实验操作是
生成的实验操作是
您最近一年使用:0次
名校
解题方法
4 . 硫酸铁是水处理行业用作净水的混凝剂和污泥的处理剂,广泛用于水的处理。一种以黄铁矿烧渣(主要成分为 、FeO、
、FeO、 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)
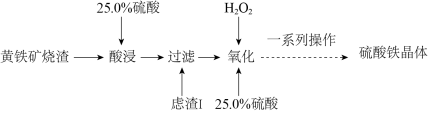
(1)“酸浸”前将黄铁矿烧渣粉碎的目的是
(2)已知:25.0%硫酸的密度
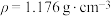 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为 的浓硫酸配制500mL 25.0%硫酸,则需用量筒量18
的浓硫酸配制500mL 25.0%硫酸,则需用量筒量18 的浓硫酸的体积为
的浓硫酸的体积为(3)“酸浸”后过滤所得滤液中所含的阳离子有
(4)“氧化”过程发生反应的离子方程式为
 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为
您最近一年使用:0次
名校
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 和
和 的混合溶液中回收S,反应历程如图。下列说法正确的是
的混合溶液中回收S,反应历程如图。下列说法正确的是
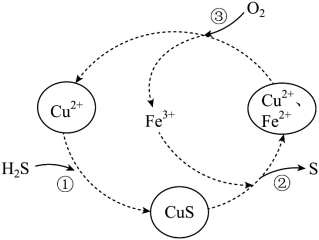
A.①反应的离子方程式为: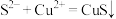 |
B.反应中, 、 、 可以循环利用 可以循环利用 |
C.由反应②③可知氧化性的强弱顺序: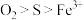 |
D.回收S的总反应为: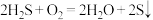 |
您最近一年使用:0次
2024·山东济宁·一模
6 . 从废旧磷酸铁锂电极材料(LiFePO4、导电石墨、铝箔)中回收锂的工艺流程如图,下列说法错误的是
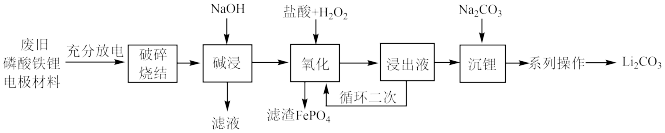
| A.旧电池拆解前进行充分放电是因为放电可使Li+在负极富集 |
| B.“氧化”时,H2O2可用KClO3代替 |
| C.“氧化”时发生的化学反应方程式为:2LiFePO4+H2O2+2HCl=2LiCl+2FePO4+2H2O |
| D.“系列操作”具体包括水浴加热、趁热过滤、洗涤、干燥 |
您最近一年使用:0次
名校
解题方法
7 . 一种由湿法炼铜的低铜萃取余液(含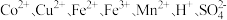 )回收金属的工艺流程如下:
)回收金属的工艺流程如下:
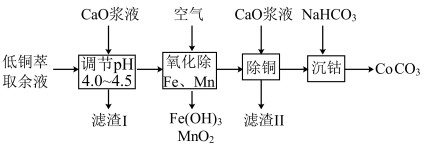
室温下,溶液中金属离子开始沉淀和完全沉淀的 如表所示。下列说法正确的是
如表所示。下列说法正确的是
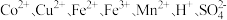 )回收金属的工艺流程如下:
)回收金属的工艺流程如下:
室温下,溶液中金属离子开始沉淀和完全沉淀的
 如表所示。下列说法正确的是
如表所示。下列说法正确的是| 金属离子 | 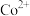 |  | 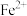 | 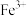 | 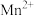 |
开始沉淀时的 | 7.8 | 5.5 | 5.8 | 1.8 | 8.3 |
完全沉淀时的 | 9.4 | 6.7 | 8.8 | 2.9 | 10.9 |
A.“滤渣I”的主要成份为 |
B.氧化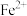 时发生反应的离子方程式为: 时发生反应的离子方程式为: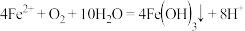 |
C.“沉钴”时,用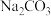 溶液代替 溶液代替 溶液可以提高 溶液可以提高 的纯度 的纯度 |
D. 溶液中存在:c(Na+)+c(H+)=c( 溶液中存在:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
8 . 草酸晶体(H2C2O4⋅2H2O)用途广泛,易溶于水,其制备及纯度测定实验如下。
I.制备
步骤1:将mg淀粉溶于水与少量硫酸加入反应器中,保持85~90℃约30min,然后逐渐降温至60℃左右。
步骤2:控制反应温度在55~60℃条件下,边搅拌边缓慢滴加含有适量催化剂的混酸(65%硝酸与98%硫酸),主要反应为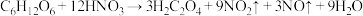 。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体
。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体 。
。
Ⅱ.纯度测定
称取制得的草酸晶体 ,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
I.制备
步骤1:将mg淀粉溶于水与少量硫酸加入反应器中,保持85~90℃约30min,然后逐渐降温至60℃左右。
步骤2:控制反应温度在55~60℃条件下,边搅拌边缓慢滴加含有适量催化剂的混酸(65%硝酸与98%硫酸),主要反应为
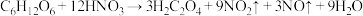 。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体
。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体 。
。Ⅱ.纯度测定
称取制得的草酸晶体
 ,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是| A.配制溶液时容量瓶底部残留少量水,会导致所配溶液浓度偏低 |
| B.滴加“混酸”速度过快,不影响草酸晶体的产率 |
| C.锥形瓶用草酸溶液润洗,所测产品纯度会偏低 |
| D.滴定终点读数时仰视,所测产品纯度偏高 |
您最近一年使用:0次
9 . 钠是一种非常活泼、具有广泛应用的金属。
(1)金属钠非常活泼,通常保存在___________ 里,以隔绝空气。
(2)汽车安全气囊的气体发生剂 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
①当汽车发生较严重的碰撞时,引发 分解
分解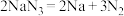 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目___________ 。
②产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:___________ 。
③ 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:___________ 。
(3)工业通过电解NaCl生产金属钠: ,过程如图:
,过程如图:
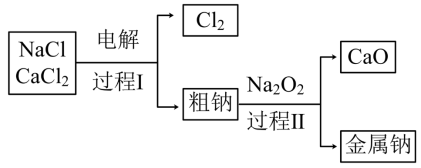
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把培点降至约580℃。
从而把培点降至约580℃。
①NaCl固体加热至熔融状态,目的是___________ 。
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:___________ 。
③过程Ⅰ中, 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:___________ 。
(1)金属钠非常活泼,通常保存在
(2)汽车安全气囊的气体发生剂
 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。①当汽车发生较严重的碰撞时,引发
 分解
分解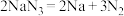 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目②产生的Na立即与
 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:③
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:(3)工业通过电解NaCl生产金属钠:
 ,过程如图:
,过程如图:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把培点降至约580℃。
从而把培点降至约580℃。①NaCl固体加热至熔融状态,目的是
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:
③过程Ⅰ中,
 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:
您最近一年使用:0次
名校
10 . 大连理工大学课题组通过CuO/ 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,1.12L NO中含有电子数为1.5 |
B.将 个 个 溶于100mL水中,所得溶液的质量分数约为29.9% 溶于100mL水中,所得溶液的质量分数约为29.9% |
C.生成22g  能消除NO的数目为0.2 能消除NO的数目为0.2 |
D.若NO和CO混合气体的平均相对分子质量为29,则含有CO的数目为0.5 |
您最近一年使用:0次
2024-03-13更新
|
280次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高一上学期第二次月考化学试卷



