解题方法
1 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、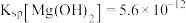 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、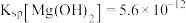 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近半年使用:0次
7日内更新
|
120次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
名校
解题方法
2 . 过二硫酸钠(Na2S2O8)是白色晶状粉末,易溶于水,不溶于乙醇,加热至65℃就会发生分解,常用作漂白剂,金属表面处理剂等。实验室以过氧化氢、浓硫酸和碳酸钠为原料制备过二硫酸钠。
I.过一硫酸(H2SO5)的合成
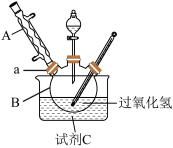
原理:H2O2+H2SO4=H2SO5+H2O。________ 。
(2)水槽中盛放的试剂C是________ (填“冰水”或“热水”)。
Ⅱ.过二硫酸钠(Na2S2O8)的合成
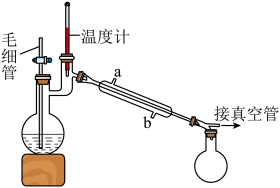
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:________ ,2Na2SO4+H2SO5=2Na2S2O8+H2O。
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是_________________ 。
(5)1mol Na2S2O8中存在的-O-O-数目为________ 。
(6)Na2S2O8具有强氧化性,可将I-氧化为I2: +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:_____________ 、__________ 。
(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:____________ 。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。
(2)水槽中盛放的试剂C是
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是
(5)1mol Na2S2O8中存在的-O-O-数目为
(6)Na2S2O8具有强氧化性,可将I-氧化为I2:
 +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:

您最近半年使用:0次
名校
3 . 铁铬废泥是FeCl3蚀刻废液经还原、碱沉淀后产生的固体废泥(铁质量分数约为15%,铬质量分数约为2%,不溶物含量为5%~10%,含水率为40%~50%),可用酸洗废液(所含酸主要是盐酸)酸溶后,再经过下列方式处理获得FeCl3和PbCrO4两种产品,变废为宝。
Ⅱ.几种金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Cr原子的价层电子排布式为________ 。
(2)铁铬废泥中铁元素和铬元素的存在形式是________ (填化学式)。
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是________________ 。
(4)加入Ca(OH)2时,应调节的pH范围为________ 。
(5)试剂A的最佳选择是________ (填字母)。
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是________________ 。
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为________ (用字母m、c、V来表示)。已知:I2+2 =2I-+
=2I-+ 。
。
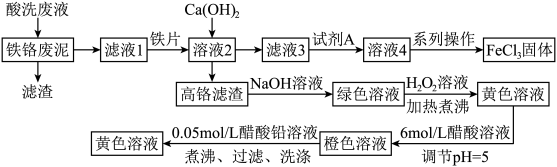
| 物质 | Cr(OH)3 |  |  |  | PbCrO4 |
| 颜色状态 | 绿色沉淀 | 绿色溶液 | 黄色溶液 | 橙色溶液 | 黄色沉淀 |
| 金属离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀的pH | 2.3 | 7.6 | 4.5 |
| 完全沉淀的pH | 3.3 | 9.1 | 5.6 |
(1)基态Cr原子的价层电子排布式为
(2)铁铬废泥中铁元素和铬元素的存在形式是
(3)用酸洗废液酸溶时,反应温度为65℃,此时铁铬废泥的浸出效果较佳。但实际生产中,只需要将溶液预热到60℃左右即可,原因是
(4)加入Ca(OH)2时,应调节的pH范围为
(5)试剂A的最佳选择是
a.酸性KMnO4溶液 b.HNO3 c.Cl2
(6)绿色溶液转化为黄色溶液过程的离子方程式是
(7)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶;用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液;充分反应后,滴入淀粉指示剂并用cmol·L-1Na2S2O3溶液滴定用去VmL。样品中氯化铁的质量分数为
 =2I-+
=2I-+ 。
。
您最近半年使用:0次
名校
4 . 为测定草酸钴晶体(CoC2O4·2H2O)样品的纯度,某实验小组进行如下实验:
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为______________ 。
(2)实验室使用的酸性KMnO4溶液一般是用________ 酸化(填酸的化学式)。
(3)步骤Ⅱ中,不会用到下列仪器中的_______ (填标号)。_______ (填“酸式”或“碱式”)滴定管;某次滴定中,开始时滴定管读数正确,结束时仰视,则所测草酸钴品体样品的纯度会_______ (填“偏大”“偏小”或“不变”)﹔某次实验中所有实验操作和读数均无误,所测草酸钴晶体样品的纯度的误差却偏小,则可能的原因是___________ 。
(5)草酸钴晶体样品的纯度为______ %。
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗FeSO4溶液标准的体积/mL | 18.96 | 18.03 | 17.97 |
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为
(2)实验室使用的酸性KMnO4溶液一般是用
(3)步骤Ⅱ中,不会用到下列仪器中的
a.  b.
b.  c.
c.  d.
d.
(5)草酸钴晶体样品的纯度为
您最近半年使用:0次
名校
5 . 三氯化铬主要用作媒染剂及催化剂,在高温下能被氧气氧化。
I.实验室以重铬酸铵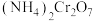 为原料合成三氯化铬
为原料合成三氯化铬
步骤1.加热使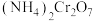 晶体分解为
晶体分解为 。
。
步骤2.取2.5 g干燥的 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。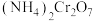 加热分解的化学方程式:
加热分解的化学方程式:___________ 。
(2)制备 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为___________ 。
(3)向A中通入 的作用为
的作用为___________ 、___________ 。其流速不能太快的原因是___________ 。
II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: 。
。
(4)下列说法正确的是___________ (填字母)。
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为___________ (保留三位有效数字)。
I.实验室以重铬酸铵
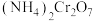 为原料合成三氯化铬
为原料合成三氯化铬步骤1.加热使
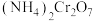 晶体分解为
晶体分解为 。
。步骤2.取2.5 g干燥的
 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
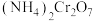 加热分解的化学方程式:
加热分解的化学方程式:(2)制备
 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为(3)向A中通入
 的作用为
的作用为II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g
 ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: 。
。(4)下列说法正确的是
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为
您最近半年使用:0次
6 . 叠氮化钠 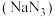 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备
水合肼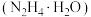 与亚硝酸甲酯
与亚硝酸甲酯 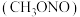 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示: 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。
(1) 的电子式为
的电子式为_______ ; 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为_______ 。
(2)装置中多孔球泡的作用是_______ 。
(3)锥形瓶中水合与亚硝酸甲酯在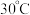 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:_______ 。
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
② 在
在 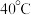 时分解。
时分解。
(4)实验时冷凝管中冷却水要_______ (填“ 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。
(5)甲醇回收时需用减压蒸馏的原因是_______ 。
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 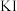 溶液消耗过量的
溶液消耗过量的 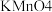 溶液;其后用
溶液;其后用 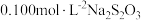 ,标准溶液滴定所产生的
,标准溶液滴定所产生的  ,消耗
,消耗  溶液
溶液 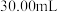 。
。
(6)实验所得产品的纯度为_______ ;若加入的 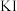 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度_______ (填“偏低”、“偏高”、“不变”)。
已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;
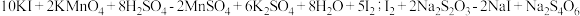 。
。
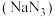 是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:
是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊等。回答下列问题:Ⅰ.实验室制备

水合肼
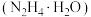 与亚硝酸甲酯
与亚硝酸甲酯 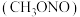 在氢氧化钠存在下制备
在氢氧化钠存在下制备  ,其反应装置如图所示:
,其反应装置如图所示:
 无色无味,微溶于醇,溶于水。
无色无味,微溶于醇,溶于水。(1)
 的电子式为
的电子式为 晶体中阴离子与阳离子个数之比为
晶体中阴离子与阳离子个数之比为(2)装置中多孔球泡的作用是
(3)锥形瓶中水合与亚硝酸甲酯在
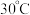 时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:
时可以反应生成叠氮化钠、甲醇等物质,写出该反应的化学方程式:Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照图所示装置进行减压蒸馏。
①
| 物质 |  |  |  |
沸点  | 64.7 | 113.5 | 300 |
 在
在 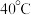 时分解。
时分解。(4)实验时冷凝管中冷却水要
 进
进  出”或 “
出”或 “ 进
进  出”)。
出”)。(5)甲醇回收时需用减压蒸馏的原因是
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得
 湿品;再用去离子水重结晶得
湿品;再用去离子水重结晶得  产品并用碘量法测定产品纯度。取产品
产品并用碘量法测定产品纯度。取产品  加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入
加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入  溶液,溶液呈紫红色;再加入足量
溶液,溶液呈紫红色;再加入足量 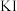 溶液消耗过量的
溶液消耗过量的 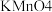 溶液;其后用
溶液;其后用 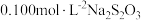 ,标准溶液滴定所产生的
,标准溶液滴定所产生的  ,消耗
,消耗  溶液
溶液 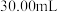 。
。(6)实验所得产品的纯度为
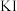 溶液有部分被空气中的氧气氧化,则测得产品的纯度
溶液有部分被空气中的氧气氧化,则测得产品的纯度已知:①产品中杂质不参与反应。
②测定过程中发生的反应:
 ;
;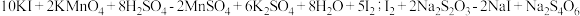 。
。
您最近半年使用:0次
解题方法
7 . 无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。
(1)氯化炉中 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ ;炉气中残余的少量 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为___________ 。
(2)700℃时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)___________ 。
A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是___________ 。
(4)为测定制得的无水 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
①上述除杂过程中涉及的离子方程式为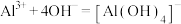 、
、___________ 。
②无水 产品的纯度为
产品的纯度为___________ 。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: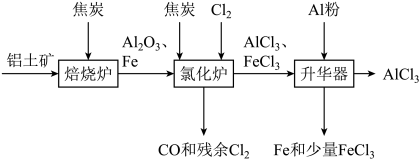
 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。(1)氯化炉中
 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为(2)700℃时,升华器中物质经充分反应后需降温实现
 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是
(4)为测定制得的无水
 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。①上述除杂过程中涉及的离子方程式为
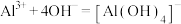 、
、②无水
 产品的纯度为
产品的纯度为
您最近半年使用:0次
名校
解题方法
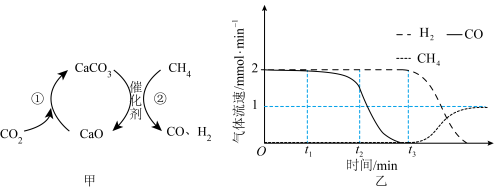
8 . 一种捕获 并实现资源利用的反应原理如图甲所示。反应①完成之后,以
并实现资源利用的反应原理如图甲所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了制反应(反应③):
,在催化剂上有积碳,推测发生了制反应(反应③): 。
。___________ 。
2. 时间段内,反应②速率减小至0的原因是
时间段内,反应②速率减小至0的原因是___________ 。
3. 时刻,生成
时刻,生成 的速率反应②___________反应③。
的速率反应②___________反应③。
 并实现资源利用的反应原理如图甲所示。反应①完成之后,以
并实现资源利用的反应原理如图甲所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了制反应(反应③):
,在催化剂上有积碳,推测发生了制反应(反应③): 。
。
2.
 时间段内,反应②速率减小至0的原因是
时间段内,反应②速率减小至0的原因是3.
 时刻,生成
时刻,生成 的速率反应②___________反应③。
的速率反应②___________反应③。A. | B. | C. | D.无法确定 |
您最近半年使用:0次
解题方法
9 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
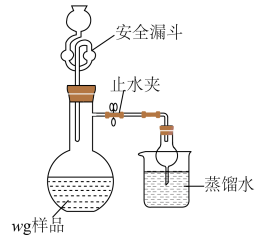
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用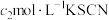 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,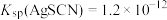 ,
,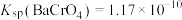 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。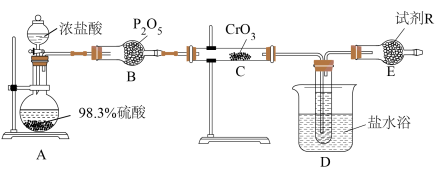
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用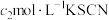 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,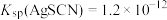 ,
,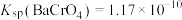 。
。
您最近半年使用:0次
10 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: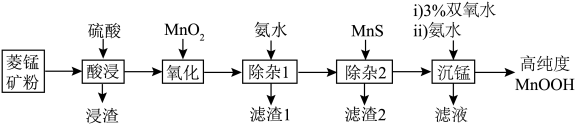
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为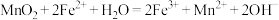 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近半年使用:0次



