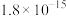解题方法
1 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,常用于消毒、杀菌、漂白等.试回答下列问题:
(1)写出酸性高锰酸钾溶液和 反应的离子方程式:
反应的离子方程式:______________ 。
(2)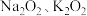 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是______________ 。
Ⅱ.某工厂废水中含 ,其浓度为
,其浓度为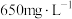 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):
(3)反应 中被氧化的元素是
中被氧化的元素是______________ 。
(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:_____________ 。
(1)写出酸性高锰酸钾溶液和
 反应的离子方程式:
反应的离子方程式:(2)
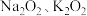 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是Ⅱ.某工厂废水中含
 ,其浓度为
,其浓度为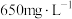 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):(3)反应
 中被氧化的元素是
中被氧化的元素是(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:

您最近半年使用:0次
名校
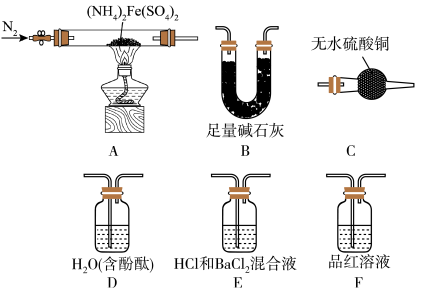
2 . 硫酸亚铁铵 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是___________ 。
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
(5)装置B在实验Ⅱ中的作用是___________ 。
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含 或
或 :
:___________ 。
(7)实验证明 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式___________ 。
实验Ⅲ:为测定硫酸亚铁铵 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:___________ (用含w、m的式子表示)。
(9)若缺少“洗涤”步骤,最终结果会___________ (填偏大、偏小或不变)。
 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
| A.溶于水部分电离 | B.固体中只有离子键 |
| C.固体中既含离子键又含共价键 | D.能发生复分解反应或氧化还原反应 |
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
| A.都位于短周期 | B.只有一个副族元素 |
C.同主族元素非金属性: | D.同周期元素原子半径: |
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
| A.都是弱电解质 | B.都是共价化合物 | C.都是以分子构成物质 | D.氨水中只有两种离子 |
(5)装置B在实验Ⅱ中的作用是
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含
 或
或 :
:(7)实验证明
 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式实验Ⅲ:为测定硫酸亚铁铵
 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:
(9)若缺少“洗涤”步骤,最终结果会
您最近半年使用:0次
解题方法
3 . 被誉为“工业维他命”的铂族金属钌(Ru)广泛用于航天航空、石油化学、信息传感工业、制药等高科技领域。以下工艺实现了电子废弃物中铂族金属钌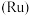 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为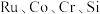 等物质,请回答以下问题:
等物质,请回答以下问题: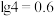 ②常见物质的
②常见物质的 如下表所示:
如下表所示:
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是______ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为______ 。
(3)“氧化溶浸”环节生成配离子 反应的离子方程式为
反应的离子方程式为______ 。
(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则 的氧化产物为
的氧化产物为______ 。
(5)滤液1中含 和
和 的浓度分别为
的浓度分别为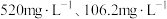 ,“调
,“调 ”时调
”时调 的范围为
的范围为______ 。(已知:当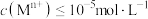 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)
(6)沉钴。向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是______ 。
(7)制备 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体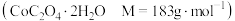 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: 点对应的物质的化学式:
点对应的物质的化学式:______ ,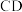 段发生反应的化学方程式为:
段发生反应的化学方程式为:______ 。
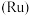 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为 等物质,请回答以下问题:
等物质,请回答以下问题: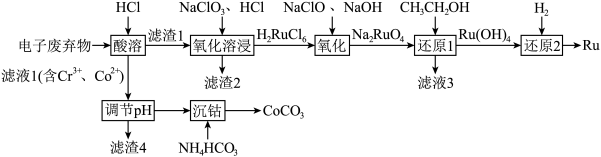
 ②常见物质的
②常见物质的 如下表所示:
如下表所示:化合物 |
|
|
|
|
|
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为
(3)“氧化溶浸”环节生成配离子
 反应的离子方程式为
反应的离子方程式为(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则
 的氧化产物为
的氧化产物为(5)滤液1中含
 和
和 的浓度分别为
的浓度分别为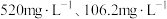 ,“调
,“调 ”时调
”时调 的范围为
的范围为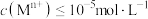 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)(6)沉钴。向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是(7)制备
 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体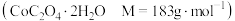 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: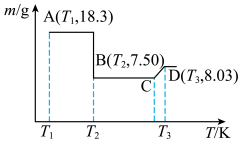
 点对应的物质的化学式:
点对应的物质的化学式: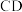 段发生反应的化学方程式为:
段发生反应的化学方程式为:
您最近半年使用:0次
解题方法
4 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。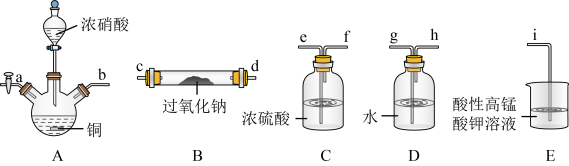
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近半年使用:0次
名校
解题方法
5 . 氮氧化物(NO、 )、
)、 是大气污染物,但在生活、生产中又有着广泛应用。
是大气污染物,但在生活、生产中又有着广泛应用。
Ⅰ.如图所示是酸雨的形成示意图。_______ (用化学方程式表示)。
(2)你认为减少酸雨的产生可采取的措施是_______(填字母)。
①减少用煤作燃料②开发新能源③化石燃料脱硫④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气⑥收集大气中氮氧化物制备硝酸
Ⅱ.某学习小组在实验室中利用下图装置制备 并进行相关性质的探究。
并进行相关性质的探究。_______ ;装置A中反应的化学方程式为_______ 。
(4)装置B是为了观察气体的流速,则试剂M为_______(填字母)。
(5)装置E中出现_______ (填现象)可说明 具有还原性。
具有还原性。
(6)装置F中过量的NaOH溶液吸收尾气发生的离子方程式为_______ 。
(7)装置C中反应的离子方程式是_______ ,甲同学设计了以下三个方案用于证实此反应中 具有还原性,你认为方案正确的是
具有还原性,你认为方案正确的是_______ 。
a.反应后溶液由黄色变为浅绿色
b.取反应后的少许溶液于试管中,加入 溶液,产生白色沉淀
溶液,产生白色沉淀
c.取反应后的少许溶液于试管中,加入 溶液,产生白色沉淀
溶液,产生白色沉淀
乙同学查阅资料发现反应分为两步:
第一步: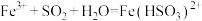 (棕红色)
(棕红色)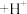 (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
由此乙同学预测实验现象是_______ 。
(8)实验开始后,发现装置D中的溶液迅速变黄,继续通入 ,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: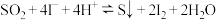 。有同学认为除
。有同学认为除 的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(
的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证( 体积已折算为标准状况下体积)。
体积已折算为标准状况下体积)。
限选试剂:0.1mol/LKI溶液、1.0mol/LKI溶液、2.0mol/LKI溶液、蒸馏水、浓硝酸、浓盐酸
Ⅲ.电化学法处理 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示(质子即
污染,设计装置如图所示(质子即 )。
)。_______ (填“正极”或“负极”)。
(10)石墨2的电极反应式为_______ 。
(11)若22.4L(标准状况) 参与反应,则迁移
参与反应,则迁移 的物质的量为
的物质的量为_______ mol。
Ⅳ.
(12)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。其中,脱硝(NO)反应的离子方程式为_______ 。
 )、
)、 是大气污染物,但在生活、生产中又有着广泛应用。
是大气污染物,但在生活、生产中又有着广泛应用。Ⅰ.如图所示是酸雨的形成示意图。

| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.75 | 4.60 | 4.58 | 4.50 | 4.50 |
(2)你认为减少酸雨的产生可采取的措施是_______(填字母)。
①减少用煤作燃料②开发新能源③化石燃料脱硫④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气⑥收集大气中氮氧化物制备硝酸
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③④⑤ | D.②③⑤⑥ |
Ⅱ.某学习小组在实验室中利用下图装置制备
 并进行相关性质的探究。
并进行相关性质的探究。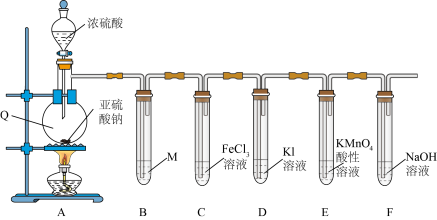
(4)装置B是为了观察气体的流速,则试剂M为_______(填字母)。
| A.NaOH溶液 | B.饱和 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
(5)装置E中出现
 具有还原性。
具有还原性。(6)装置F中过量的NaOH溶液吸收尾气发生的离子方程式为
(7)装置C中反应的离子方程式是
 具有还原性,你认为方案正确的是
具有还原性,你认为方案正确的是a.反应后溶液由黄色变为浅绿色
b.取反应后的少许溶液于试管中,加入
 溶液,产生白色沉淀
溶液,产生白色沉淀c.取反应后的少许溶液于试管中,加入
 溶液,产生白色沉淀
溶液,产生白色沉淀乙同学查阅资料发现反应分为两步:
第一步:
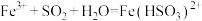 (棕红色)
(棕红色)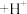 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)由此乙同学预测实验现象是
(8)实验开始后,发现装置D中的溶液迅速变黄,继续通入
 ,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: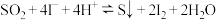 。有同学认为除
。有同学认为除 的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(
的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证( 体积已折算为标准状况下体积)。
体积已折算为标准状况下体积)。限选试剂:0.1mol/LKI溶液、1.0mol/LKI溶液、2.0mol/LKI溶液、蒸馏水、浓硝酸、浓盐酸
| 影响因素 | 编号 | 操作 | 现象 |
 | i | 取50mL | 溶液变为浅黄色 |
| ii | 取50mL1.0mo1/LKI溶液于锥形瓶中,向其中通入20mL | 溶液迅速变黄 | |
 | iii | 取50mL1.0mol/LKI溶液和 | 溶液迅速变黄 |
| iv | 取50mL1.0mol/LKI溶液和5mL | 溶液迅速变黄且出现乳黄色浑浊 |
Ⅲ.电化学法处理
 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示(质子即
污染,设计装置如图所示(质子即 )。
)。
(10)石墨2的电极反应式为
(11)若22.4L(标准状况)
 参与反应,则迁移
参与反应,则迁移 的物质的量为
的物质的量为Ⅳ.
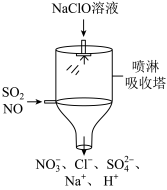
(12)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。其中,脱硝(NO)反应的离子方程式为
您最近半年使用:0次
名校
6 . 硫酸亚铁铵晶体又称摩尔盐,是浅蓝绿色结晶或粉末,对光敏感,在空气中逐渐风化及氧化;易溶于水,几乎不溶于乙醇。摩尔盐是一种重要的化工原料,用途十分广泛。可以作净水剂,是制取氧化铁系颜料、磁性材料、黄血盐和其他铁盐等的原料;它还可用作印染工业的媒染剂,制革工业中用于鞣革,木材工业中用作防腐剂,医药中用于治疗缺铁性贫血,农业中施用于缺铁性土壤,畜牧业中用作饲料添加剂等,还可以用于配制蓝黑墨水。以黄铁矿(主要成分为 )为原料制备摩尔盐[
)为原料制备摩尔盐[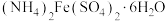 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:___________ 。
(2)溶液E中的溶质为___________ (填化学式)。
(3)试剂X为___________ (填化学式),写出少量该试剂在加热条件下与D的浓溶液反应的化学方程式:___________ 。
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、___________ 。
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是___________ 。
 )为原料制备摩尔盐[
)为原料制备摩尔盐[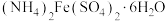 ]的工艺流程如图所示,回答下列问题:
]的工艺流程如图所示,回答下列问题:
(2)溶液E中的溶质为
(3)试剂X为
(4)由溶液E和过量X反应后,需分离溶液F和固体G,使用的玻璃仪器有烧杯、
(5)得到摩尔盐时需在惰性气体环境下进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,在惰性气体环境下进行该系列操作的目的是
您最近半年使用:0次
名校
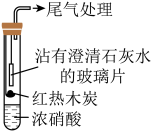
7 . 某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验装置如图:
①液面上方红棕色气体的主要成分是___________ 。
②沾有澄清石灰水的玻璃片出现浑浊,___________ (填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为___________ 。
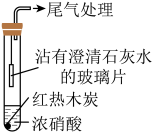
(2)乙同学设计实验装置如图:___________ (填“能”或“不能”)说明木炭与浓硝酸未反应,是因为___________ 。
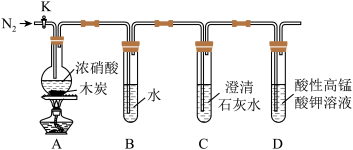
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验装置如图 (夹持装置已省略)。已知酸性高锰酸钾溶液能将 、
、 氧化成
氧化成 ,
, 被还原为
被还原为 。
。 ,目的为
,目的为___________ 。
②装置A中木炭与浓硝酸反应的化学方程式为___________ 。
③能证明木炭被氧化的实验现象为___________ 。
④装置D中发生反应的离子方程式为___________ 。
(1)甲同学设计实验装置如图:
①液面上方红棕色气体的主要成分是
②沾有澄清石灰水的玻璃片出现浑浊,
(2)乙同学设计实验装置如图:
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验装置如图 (夹持装置已省略)。已知酸性高锰酸钾溶液能将
 、
、 氧化成
氧化成 ,
, 被还原为
被还原为 。
。
 ,目的为
,目的为②装置A中木炭与浓硝酸反应的化学方程式为
③能证明木炭被氧化的实验现象为
④装置D中发生反应的离子方程式为
您最近半年使用:0次
名校
解题方法
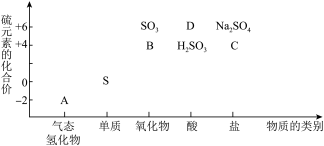
8 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”,根据图示回答下列问题:___________ 性。足量B通入溴水中反应的离子方程式是___________ ,体现了B的___________ 性。
(2)从物质的性质分析,B不可用___________ 进行干燥(填标号)。
A.浓硫酸 B.碱石灰 C.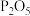 固体
固体
(3)C是一种常见的易溶于水的酸式盐,将A通入C的溶液中,溶液会变浑浊,此时对应反应的离子方程式为___________ 。
(4)含硫化合物中除 、0、
、0、 和
和 之外,也会有其他价态,海波就是其中一种。海波化学名称为硫代硫酸钠
之外,也会有其他价态,海波就是其中一种。海波化学名称为硫代硫酸钠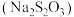 ,易溶于水。从其组成的角度分析,其应该具有较强的还原性,可以使酸性的重铬酸钾
,易溶于水。从其组成的角度分析,其应该具有较强的还原性,可以使酸性的重铬酸钾 溶液由橙黄色变为浅绿色
溶液由橙黄色变为浅绿色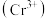 ,对应反应的离子方程式为
,对应反应的离子方程式为___________ 。欲制备 ,从氧化还原角度分析,下列选项合理的是
,从氧化还原角度分析,下列选项合理的是___________ (填标号)。
A. B.
B. C.
C. D.
D.
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为___________ 。
(2)从物质的性质分析,B不可用
A.浓硫酸 B.碱石灰 C.
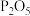 固体
固体(3)C是一种常见的易溶于水的酸式盐,将A通入C的溶液中,溶液会变浑浊,此时对应反应的离子方程式为
(4)含硫化合物中除
 、0、
、0、 和
和 之外,也会有其他价态,海波就是其中一种。海波化学名称为硫代硫酸钠
之外,也会有其他价态,海波就是其中一种。海波化学名称为硫代硫酸钠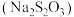 ,易溶于水。从其组成的角度分析,其应该具有较强的还原性,可以使酸性的重铬酸钾
,易溶于水。从其组成的角度分析,其应该具有较强的还原性,可以使酸性的重铬酸钾 溶液由橙黄色变为浅绿色
溶液由橙黄色变为浅绿色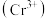 ,对应反应的离子方程式为
,对应反应的离子方程式为 ,从氧化还原角度分析,下列选项合理的是
,从氧化还原角度分析,下列选项合理的是A.
 B.
B. C.
C. D.
D.
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为
您最近半年使用:0次
解题方法
9 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______ 。
(2)“滤液②”中含有的金属离子是______ 。
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______ 。
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是______ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______ 。
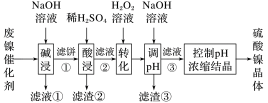

| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时 (c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时 (c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为
(4)如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近半年使用:0次
解题方法
10 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、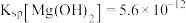 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、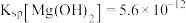 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近半年使用:0次
7日内更新
|
120次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学