名校
解题方法
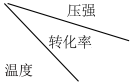
1 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
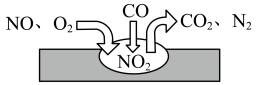
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近半年使用:0次
名校
解题方法
2 . 氧化亚铜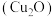 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
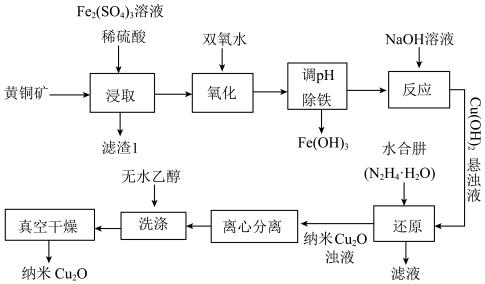
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。
已知: (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇;
 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。___________ 和 。
。
(2)写出浸取时发生反应的离子方程式___________ 。
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式___________ ,每生成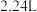 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为___________ 。
(4)洗涤过程中,用无水乙醇洗涤的目的是___________ 。
(5)证明得到的 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是___________ 。
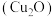 是一种半导体材料。纳米
是一种半导体材料。纳米 还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为
还具有极强的吸附性能、低温顺磁性等特性,应用于光催化降解领域。以黄铜矿(主要成分为 ,含少量
,含少量 的氧化物、
的氧化物、 等)为原料制备纳米
等)为原料制备纳米 的工艺流程如图。
的工艺流程如图。已知:
 (砖)红色粉末状固体,几乎不溶于水和乙醇;
(砖)红色粉末状固体,几乎不溶于水和乙醇; 在潮湿的空气中会慢慢氧化生成
在潮湿的空气中会慢慢氧化生成 。
。
 。
。(2)写出浸取时发生反应的离子方程式
(3)“还原”过程中,产生无色无味的气体。写出该过程中发生反应的化学反应方程式
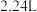 (标准状况下)
(标准状况下) ,转移电子数为
,转移电子数为(4)洗涤过程中,用无水乙醇洗涤的目的是
(5)证明得到的
 是纳米级微粒的具体方法是
是纳米级微粒的具体方法是
您最近半年使用:0次
名校
3 . 某化学兴趣小组利用如图装置,制备 并探究
并探究 的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
(2)请写出该实验中制备 的化学反应方程式
的化学反应方程式___________ 。
(3)湿润的 试纸的变化
试纸的变化___________ 。
(4)请写出 与
与 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式___________ 。
(5)拆装置前,需要进行的操作是___________ ,工业上通常使用氨水吸收 ,获得的产物有什么用途(列举一种即可)
,获得的产物有什么用途(列举一种即可)___________ 。
(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的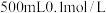 的酸性
的酸性 溶液中。已知
溶液中。已知 与该溶液反应的化学方程式为
与该溶液反应的化学方程式为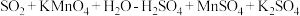 (未配平)若管道中空气流量为
(未配平)若管道中空气流量为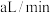 ,经过
,经过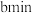 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可被溶液充分吸收。则空气样品中
可被溶液充分吸收。则空气样品中 的含量是
的含量是___________ 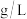 (用含
(用含 、
、 代数式表示)。
代数式表示)。
 并探究
并探究 的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题:
的部分性质,实验装置如图所示(装置的气密性已检查)。回答下列问题: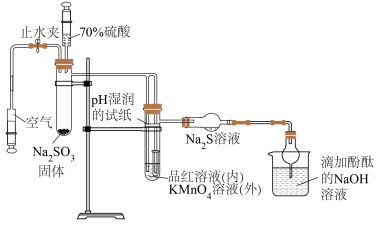
A. | B. | C. | D. |
(2)请写出该实验中制备
 的化学反应方程式
的化学反应方程式(3)湿润的
 试纸的变化
试纸的变化(4)请写出
 与
与 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式(5)拆装置前,需要进行的操作是
 ,获得的产物有什么用途(列举一种即可)
,获得的产物有什么用途(列举一种即可)(6)实验完成后,该小组同学将实验室内空气样品经过管道通入密闭容器中的
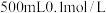 的酸性
的酸性 溶液中。已知
溶液中。已知 与该溶液反应的化学方程式为
与该溶液反应的化学方程式为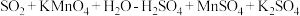 (未配平)若管道中空气流量为
(未配平)若管道中空气流量为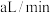 ,经过
,经过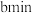 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可被溶液充分吸收。则空气样品中
可被溶液充分吸收。则空气样品中 的含量是
的含量是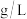 (用含
(用含 、
、 代数式表示)。
代数式表示)。
您最近半年使用:0次
名校
4 . 下列反应的离子方程式正确的是
A. 与 与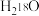 反应: 反应: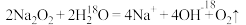 |
B.用 溶液吸收废气中的 溶液吸收废气中的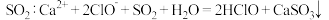 |
C.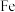 与稀硝酸反应:当 与稀硝酸反应:当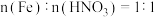 时, 时, |
D. 溶液与少量 溶液与少量 溶液反应: 溶液反应: |
您最近半年使用:0次
5 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
(1)“浸出”步骤中,碲和硒两种元素分别转化为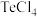 和
和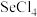 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是___________ 。
(2)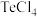 的沸点(387℃)高于
的沸点(387℃)高于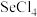 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是___________ 。
(3)“净化”步骤中产生的滤渣主要含___________ (写化学式)和少量硒单质。
(4)化学反应的吉布斯自由能变 。
。 还原
还原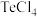 和
和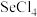 的
的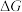 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过___________ K,该步骤控制在此温度以下的原因是___________ 。___________ 。
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是___________ (填标号)。
A.铁粉 B.氢气 C.硫化钠
 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。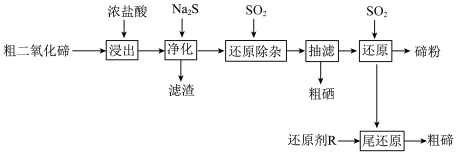
(1)“浸出”步骤中,碲和硒两种元素分别转化为
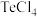 和
和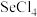 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是(2)
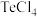 的沸点(387℃)高于
的沸点(387℃)高于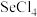 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是(3)“净化”步骤中产生的滤渣主要含
(4)化学反应的吉布斯自由能变
 。
。 还原
还原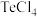 和
和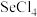 的
的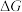 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过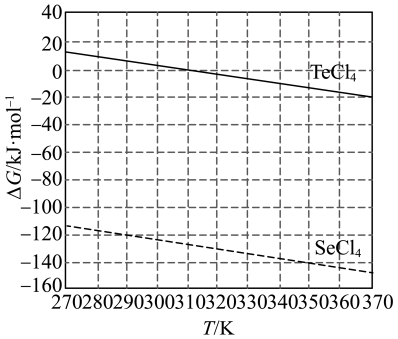
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是
A.铁粉 B.氢气 C.硫化钠
您最近半年使用:0次
7日内更新
|
186次组卷
|
2卷引用:河南省周口市2024届高三二模理综-化学试题
名校
解题方法
6 . 硫铁矿(主要成分为FeS2)是工业制硫酸的主要原料。硫铁矿烧渣中含有Fe2O3、Fe3O4、Al2O3等成分,可用于制备硫酸和绿矾(FeSO4·7H2O),流程示意图如下。
(1)硫元素位于周期表中第___________ 周期,第___________ 族。
(2)硫铁矿煅烧时反应的化学方程式为___________ 。
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
为提高SO2的转化率,该反应应选择的温度是___________ ℃,压强采用“常压”的主要原因为___________ 。
(4)“还原”和“除铝”能否交换顺序?___________ (填“能”或“否”),原因是___________
(5)“结晶”过程的步骤如下:___________ (填操作和现象)。
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++ +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为___________ 。
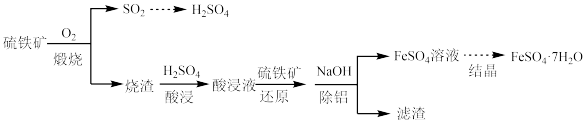
| Fe3+ | A13+ | Fe2+ | |
| 开始沉淀时的pH | |1.5 | 3.3 | 6.5 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 |
(1)硫元素位于周期表中第
(2)硫铁矿煅烧时反应的化学方程式为
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(4)“还原”和“除铝”能否交换顺序?
(5)“结晶”过程的步骤如下:
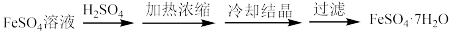
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++
 +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
您最近半年使用:0次
名校
7 . 下列有关电极反应式或离子方程式书写错误的是
A.氢氧碱性燃料电池正极反应式: |
B.实验室制氯气: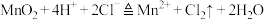 |
C.向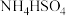 溶液中滴加少量的 溶液中滴加少量的 溶液: 溶液: |
D.向 溶液中滴加稀硫酸: 溶液中滴加稀硫酸: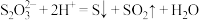 |
您最近半年使用:0次
名校
解题方法
8 . 工业废水中的氨氮(以 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
② 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入 ,氨氮转化为
,氨氮转化为 而除去。
而除去。
① 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
②一定 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。 :
: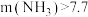 时,总氮的去除率随
时,总氮的去除率随 :
: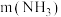 的增大不升反降的原因是
的增大不升反降的原因是_______ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,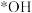 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。_______ 。
②其它条件不变调节废水的 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。 晶体进行纯度测定:
晶体进行纯度测定:
a.称取 样品,将其配成
样品,将其配成 溶液。
溶液。
b.先向锥形瓶内加入一定浓度的 溶液,加热至
溶液,加热至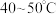 。冷却后再向其中加入
。冷却后再向其中加入
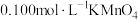 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液 。
。
(NaNO2与 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)
通过计算,该样品中 的质量分数是
的质量分数是_______ 。(写出计算过程)
 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入
 ,氨氮转化为
,氨氮转化为 而除去。
而除去。①
 氧化
氧化 的离子方程式为
的离子方程式为②一定
 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。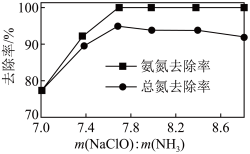
 :
: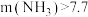 时,总氮的去除率随
时,总氮的去除率随 :
: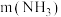 的增大不升反降的原因是
的增大不升反降的原因是(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,
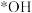 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。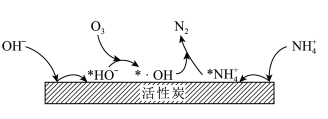
②其它条件不变调节废水的
 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是
 晶体进行纯度测定:
晶体进行纯度测定:a.称取
 样品,将其配成
样品,将其配成 溶液。
溶液。b.先向锥形瓶内加入一定浓度的
 溶液,加热至
溶液,加热至 。冷却后再向其中加入
。冷却后再向其中加入
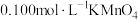 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液
 。
。(NaNO2与
 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)通过计算,该样品中
 的质量分数是
的质量分数是
您最近半年使用:0次
名校
解题方法
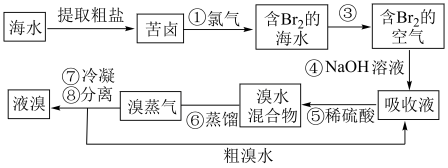
9 . 溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。空气吹出法工艺利用制盐后的卤水提取溴。这种卤水含溴离子的浓度很低,在生产中用下列方法制取液溴。 、
、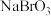
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含 的海水”中溴的质量分数
的海水”中溴的质量分数___________ (填“高”、“低”)。
(2)步骤③的操作是:___________________ ;经过该操作获得含 的空气,利用了
的空气,利用了
_________________ 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:_______________________ 。
(3)步骤④和⑤的目的是:__________________ ;步骤④用浓的 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:___________________ 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:___________ ,然后操作名称是:___________ 。
 、
、
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含
 的海水”中溴的质量分数
的海水”中溴的质量分数(2)步骤③的操作是:
 的空气,利用了
的空气,利用了
步骤⑥的蒸馏过程中,溴出口温度要控制在
 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:(3)步骤④和⑤的目的是:
 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:
您最近半年使用:0次
名校
10 . 自然界中的局部氮循环如下图所示。
(1)氮气的电子式为___________ 。
(2)上图各含氮物质的转化途径中,属于氮的固定的是___________ (填数字序号)。
(3)NH3是氮循环中的重要物质,工业合成NH3的化学方程式为___________ 。
(4)某化工厂出现泄蹈,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH上升,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是___________ (填标号)。
A.循环水的pH上升与氨水的碱性有关
B.过量氨进入循环水后,不会导致水体富营养化
C.过量氨进入循环水后,水中 和
和 含量会升高
含量会升高
D.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c( )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为
氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为___________ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:___________ 。
___________ +___________ FeS2+___________ H+
+___________ FeS2+___________ H+ ___________N2↑+___________
___________N2↑+___________  +___________ Fe3+___________
+___________ Fe3+___________
该反应中被氧化的物质为___________ 。
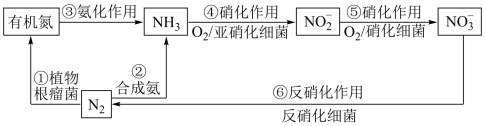
(1)氮气的电子式为
(2)上图各含氮物质的转化途径中,属于氮的固定的是
(3)NH3是氮循环中的重要物质,工业合成NH3的化学方程式为
(4)某化工厂出现泄蹈,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为Cl2)的杀菌效果降低、硝化作用增强,导致循环水的pH上升,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是
A.循环水的pH上升与氨水的碱性有关
B.过量氨进入循环水后,不会导致水体富营养化
C.过量氨进入循环水后,水中
 和
和 含量会升高
含量会升高D.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的c(
 )可判断循环水的水质是否恶化,c(
)可判断循环水的水质是否恶化,c( )检测利用的是酸性条件下I-被
)检测利用的是酸性条件下I-被 氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为
氧化为I2,同时生成的气体遇空气变红棕色,该反应的离子方程式为(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:___________
 +___________ FeS2+___________ H+
+___________ FeS2+___________ H+ ___________N2↑+___________
___________N2↑+___________  +___________ Fe3+___________
+___________ Fe3+___________该反应中被氧化的物质为
您最近半年使用:0次