解题方法
1 . 下表列出了A~R9种元素在周期表中的位置:
请回答下列问题。
(1)这些元素分别为:A___________ ,B___________ ,C___________ ,D___________ ,E___________ ,F___________ ,G___________ ,R___________ ,其中化学性质最不活泼的是___________ (用元素符号表示)。
(2)画出G的原子结构示意图___________ 。
(3)元素周期表共有___________ 个周期___________ 个族,18纵行元素化合价通常表现为___________ 价所以称为0族元素,又叫惰性气体元素。A位于___________ 周期___________ 族
(4)H元素与A元素形成的化合物高温灼烧时,火焰呈___________ 色。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(1)这些元素分别为:A
(2)画出G的原子结构示意图
(3)元素周期表共有
(4)H元素与A元素形成的化合物高温灼烧时,火焰呈
您最近一年使用:0次
2024-01-05更新
|
150次组卷
|
2卷引用:贵州省清镇市博雅实验学校2023-2024学年高一上学期第四次月考化学试卷
名校
2 . 航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料。
(1)写出高氯酸铵组成元素中,原子核外有三层电子的原子的结构示意图___________ 。
(2)高氯酸铵对应酸高氯酸HClO4的酸酐是___________ 。
(3)150℃时高氯酸铵发生分解反应:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为___________ 。
(1)写出高氯酸铵组成元素中,原子核外有三层电子的原子的结构示意图
(2)高氯酸铵对应酸高氯酸HClO4的酸酐是
(3)150℃时高氯酸铵发生分解反应:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为
您最近一年使用:0次
名校
3 . 肼(N2H4)是重要的化工原料,能与水、乙醇等混溶;它是一种二元弱碱,在水中的电离方式与氨相似,室温下电离常数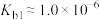 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。
(1)写出N元素在元素周期表中的位置___________ 。
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式___________ 。
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步: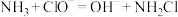
①写出第二步反应的离子方程式___________ 。
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)___________ 。
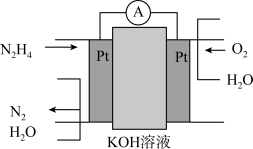
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为___________ 。
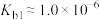 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。(1)写出N元素在元素周期表中的位置
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
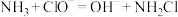
①写出第二步反应的离子方程式
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为

您最近一年使用:0次
4 . 元素周期表是学习和研究化学的重要工具,下面是元素周期表的部分内容,请根据下表回答问题:
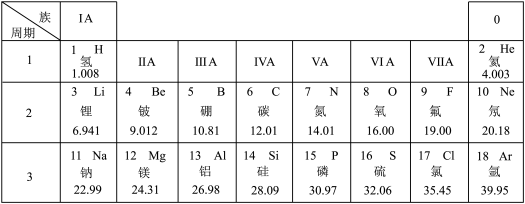
(1)发现了元素周期律并编制出元素周期表的化学家是___________(填字母)。
(2)氟元素是人体必需微量元素之一,能防治龋齿。氟元素的相对原子质量为___________ 。
(3)已知某微粒的结构示意图为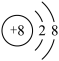 ,请写出该微粒的符号
,请写出该微粒的符号___________ 。
(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物的化学式为___________ 。

(1)发现了元素周期律并编制出元素周期表的化学家是___________(填字母)。
| A.门捷列夫 | B.拉瓦锡 | C.道尔顿 | D.阿伏加德罗 |
(3)已知某微粒的结构示意图为
 ,请写出该微粒的符号
,请写出该微粒的符号(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物的化学式为
您最近一年使用:0次
5 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有___________ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为___________ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有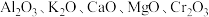 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为___________ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为___________ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有___________ (填元素符号)。
(4)我国科研人员研制出了 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、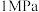 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
___________ 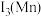 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
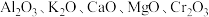 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了
 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、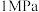 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
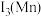 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
名校
6 . 近年来,我国航空航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷( )原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
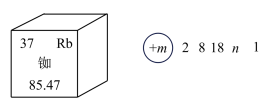
(1)下列说法错误的是_____(填字母)。
(2)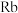 原子第一电子层上电子的能量比最外层上电子的能量
原子第一电子层上电子的能量比最外层上电子的能量_____ (填“低”或“高”)。
(3)如图2中A-E所示粒子共表示种元素;铷元素原子的化学性质与如图中_____ (填字母)的化学性质相似;属于阴离子结构示意图的是_____ (填字母);写出B与D形成化合物的化学式_____ 。
(4)在核电荷数1~10的元素内,列举两个与图2中E电子层结构相同的离子,写出离子的符号_____ 。
A.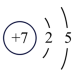 B.
B.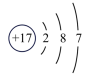 C.
C.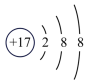 D.
D.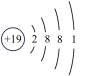 E.
E.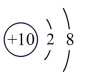
 )原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
(1)下列说法错误的是_____(填字母)。
A.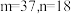 |
| B.铷是金属元素 |
| C.铷的相对原子质量是85.47 |
| D.铷原子有5个电子层,最外层有1个电子 |
(2)
 原子第一电子层上电子的能量比最外层上电子的能量
原子第一电子层上电子的能量比最外层上电子的能量(3)如图2中A-E所示粒子共表示种元素;铷元素原子的化学性质与如图中
(4)在核电荷数1~10的元素内,列举两个与图2中E电子层结构相同的离子,写出离子的符号
A.
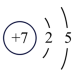 B.
B. C.
C. D.
D. E.
E.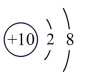
您最近一年使用:0次
名校
7 . 下表是某些短周期元素的电负性值:
(1)通过分析电负性值变化规律,确定 的电负性值范围:
的电负性值范围:_______ 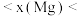
_______ 。
(2)推测 值与原子半径的关系是
值与原子半径的关系是_______ ;根据短周期元素的 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的_______ 变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:
_______ ,
_______ 。
(4)试推断 中化学键类型是
中化学键类型是_______ 。
(5)预测元素周期表中, 值最小的元素位于
值最小的元素位于_______ 周期_______ 族(放射性元素除外)。
| 元素符号 |  |  |  |  |  |  |  |  |  |  |  |  |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定
 的电负性值范围:
的电负性值范围: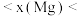
(2)推测
 值与原子半径的关系是
值与原子半径的关系是 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的(3)分别指出下列两种化合物中氧元素的化合价:


(4)试推断
 中化学键类型是
中化学键类型是(5)预测元素周期表中,
 值最小的元素位于
值最小的元素位于
您最近一年使用:0次
8 . Al在周期表中的位置是________ 。基态C原子核外最外层电子的轨道表示式是______ ,Zn是第30号元素,则基态Zn的价层电子排布式是________ 。
您最近一年使用:0次
名校
解题方法
9 . 下表列出了A~R9种元素在周期表中的位置。请回答下列问题。
(1)在这9种元素中,最外层电子数为1的元素为_____ (填元素符号),化学性质最不活泼的是_____ (填元素符号)。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应水化物反应的离子方程式是_____ 。
(3)F、A、D三种元素的离子半径由大到小的顺序排列为_____ (填离子符号)。
(4)用电子式表示由C和H组成的化合物的形成过程:_____ 。
(5)由E和F形成的氧化物通入足量的B的氢氧化物中,其离子反应方程式为_____ 。
(6)由E和G所形成的化合物中所含有的化学键为_____ 。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应水化物反应的离子方程式是
(3)F、A、D三种元素的离子半径由大到小的顺序排列为
(4)用电子式表示由C和H组成的化合物的形成过程:
(5)由E和F形成的氧化物通入足量的B的氢氧化物中,其离子反应方程式为
(6)由E和G所形成的化合物中所含有的化学键为
您最近一年使用:0次
2023-12-24更新
|
432次组卷
|
2卷引用:湖南省长郡中学2023-2024学年高一上学期选科适应性调研检测化学试题
10 . 下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
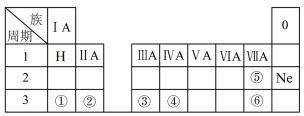
(1)元素⑤的符号是___________ 。
(2)③的最高价氧化物对应的水化物的化学式为___________ (填化学式)。
(3)④和⑥两种元素原子半径的大小关系:④___________ ⑥(填“>”或“<”)。
(4)①和②两种元素金属性强弱关系:①___________ ②(填“>”或“<”)。
(5)⑥的氢化物的电子式为___________ 。
(6)①的最高价氧化物对应的水化物与单质③的反应方程式:___________ 。

(1)元素⑤的符号是
(2)③的最高价氧化物对应的水化物的化学式为
(3)④和⑥两种元素原子半径的大小关系:④
(4)①和②两种元素金属性强弱关系:①
(5)⑥的氢化物的电子式为
(6)①的最高价氧化物对应的水化物与单质③的反应方程式:
您最近一年使用:0次



