解题方法
1 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)②的原子结构示意图为_______ 。
(2)元素③、⑤以原子个数比为 形成的化合物含有的化学键为
形成的化合物含有的化学键为_______ 。
(3)元素③、⑨与H原子以原子个数比为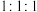 形成的化合物的电子式为
形成的化合物的电子式为_______ ,元素①、③以原子个数比为 形成的化合物的结构式为
形成的化合物的结构式为_______ 。
(4)第三周期中元素的最高价氧化物对应水化物中碱性最强的是_______ (填化学式,下同),最高价氧化物对应的水化物具有两性的物质是_______ ,简单氢化物的热稳定性最强的是_______ 。
(5)元素③、⑤、⑨形成简单离子的半径由大到小的顺序是_______ (填离子符号)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素③、⑤以原子个数比为
 形成的化合物含有的化学键为
形成的化合物含有的化学键为(3)元素③、⑨与H原子以原子个数比为
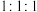 形成的化合物的电子式为
形成的化合物的电子式为 形成的化合物的结构式为
形成的化合物的结构式为(4)第三周期中元素的最高价氧化物对应水化物中碱性最强的是
(5)元素③、⑤、⑨形成简单离子的半径由大到小的顺序是
您最近一年使用:0次
名校
2 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)元素①的原子结构示意图是______ 。
(2)从元素原子得失电子的角度看,元素⑤具有_______ (填“氧化性”或“还原性”)。
(3)元素②形成的单质气体含有_______ (填“极性”或“非极性”)共价键。
(4)元素③,⑨与H原子以原子个数比为1:1:1形成的化合物的电子式为______ 。
(5)第三周期中元素的最高价氧化物对应水化物中碱性最强的是_______ (填化学式,下同),最高价氧化物对应的水化物具有两性的物质是_______ ,这两种物质反应的离子方程式为_______ 。
(6)元素③,⑤,⑨形成简单离子的半径由大到小的顺序是______ (填离子符号)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)从元素原子得失电子的角度看,元素⑤具有
(3)元素②形成的单质气体含有
(4)元素③,⑨与H原子以原子个数比为1:1:1形成的化合物的电子式为
(5)第三周期中元素的最高价氧化物对应水化物中碱性最强的是
(6)元素③,⑤,⑨形成简单离子的半径由大到小的顺序是
您最近一年使用:0次
名校
3 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
(1)元素 在元素周期表中的位置为第
在元素周期表中的位置为第_______ 周期第_______ 族。
(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子_______ 、_______ 。
(3)有以下几种粒子: 、
、 、
、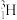 、
、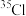 、
、 、
、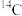 、
、 。其中含有
。其中含有_______ 种核素,互为同位素的有_______ 。由 、
、 、
、 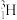 与
与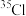 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有_______ 种。
(4)以下说法正确的是_______。
(1)元素
 在元素周期表中的位置为第
在元素周期表中的位置为第(2)分别写出由第二周期元素与H元素形成的含10电子的一个分子和一个离子
(3)有以下几种粒子:
 、
、 、
、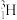 、
、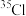 、
、 、
、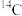 、
、 。其中含有
。其中含有 、
、 、
、 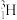 与
与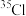 、
、  形成的氯化氢分子相对分子质量有
形成的氯化氢分子相对分子质量有(4)以下说法正确的是_______。
| A.碱金属单质和卤素单质随着核电荷数的增加,熔沸点依次升高,密度依次增大 |
| B.由于F、Cl、Br、I的非金属性依次减弱,可推出HF、HCl、HBr、HI的还原性及热稳定性依次减弱 |
| C.第85号元素砹At是核电荷数最大的卤素,其单质At2可能是一种有色固体,难溶于水易溶于有机溶剂 |
| D.在新制氯水中加入少量铁粉,发生2Fe+3Cl2=2FeCl3 |
您最近一年使用:0次
名校
解题方法
4 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
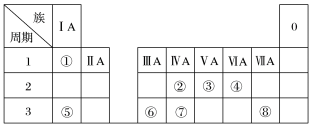
(1)地壳中含量居于第一位的元素在周期表中的位置是_______ ;
(2)画出⑤的原子结构示意图_______ ;③的最高价氧化物对应的水化物的化学式为_______ 。
(3)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为_______ ;写出⑥的单质与⑤的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(4)W是第四周期与⑧同主族的元素。据此推测W不可能 具有的性质是_______(填字母)。
(5)已知X为第ⅡA族元素(第二到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有关系:_______ 。
(6)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是_______ 。
(7)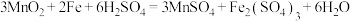 ,该反应中,每生成1mol
,该反应中,每生成1mol ,转移的电子数目为
,转移的电子数目为_______ 。

(1)地壳中含量居于第一位的元素在周期表中的位置是
(2)画出⑤的原子结构示意图
(3)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为
(4)W是第四周期与⑧同主族的元素。据此推测W
| A.最高正化合价为+7 | B.气态氢化物比HCl稳定 |
| C.最高价氧化物对应的水化物的酸性比HClO4弱 | D.单质在常温下可与氢气化合 |
(5)已知X为第ⅡA族元素(第二到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有关系:
(6)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,金属A的相对原子质量是
(7)
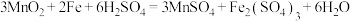 ,该反应中,每生成1mol
,该反应中,每生成1mol ,转移的电子数目为
,转移的电子数目为
您最近一年使用:0次
名校
解题方法
5 . 化学元素周期表(Periodictableofelements)是根据元素原子核电荷数从小至大排序的化学元素列表。如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y、Z分别表示某种化学元素),按要求作答。
(1)Z元素符号是___________ 。
(2)表中元素化学性质最稳定的是___________ (填元素符号)。
(3)地壳中含量最多的元素在元素周期表中的位置是___________ 。
(4)写出Na的原子结构示意图___________ 。
(5)主要用来制作高纯半导体、耐高温材料、光导纤维通信材料的元素名称是___________ 。
(6)卤族元素之一,属周期系VIIA族,在元素周期表中位于第二周期的元素是___________ 。
(7)O2与S单质相比,更难与H2化合的是___________ 。
(8)写出N元素的气态氢化物的化学式___________ ,该物质与水反应的化学方程式:___________ 。
(9)Cl2与水反应的生成物中具有漂白作用的是___________ (填化学式),写出Cl2与NaOH溶液反应的离子方程式:___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | X | N | O | F | Y | |||
| 3 | Na | Z | Al | Si | S | Cl |
(2)表中元素化学性质最稳定的是
(3)地壳中含量最多的元素在元素周期表中的位置是
(4)写出Na的原子结构示意图
(5)主要用来制作高纯半导体、耐高温材料、光导纤维通信材料的元素名称是
(6)卤族元素之一,属周期系VIIA族,在元素周期表中位于第二周期的元素是
(7)O2与S单质相比,更难与H2化合的是
(8)写出N元素的气态氢化物的化学式
(9)Cl2与水反应的生成物中具有漂白作用的是
您最近一年使用:0次
名校
6 . 按要求完成下列填空:
(1)①写出次氯酸的电子式_______ ;②漂粉精主要成分的化学式_______ 。
(2)写出 元素在元素周期表中的位置
元素在元素周期表中的位置_______ 。
(3) 与
与 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(1)①写出次氯酸的电子式
(2)写出
 元素在元素周期表中的位置
元素在元素周期表中的位置(3)
 与
与 溶液反应的化学方程式
溶液反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 人体必需的一些元素在周期表中的分布情况如下:______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是________ ,原子序数为____ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。
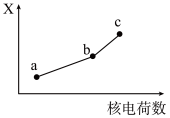
| A.若a、b、c表示氧族元素,则X表示对应氢化物的沸点 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅠA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2024-01-24更新
|
68次组卷
|
2卷引用:山东省邹城市第二中学2023-2024学年高一上学期12月月考化学试题
8 . 元素周期表是学习化学的重要工具。下表为某些元素在周期表中的位置。
(1)按①→②→③→④的顺序,其原子半径逐渐_____ (填“增大”或“减小”),得电子能力逐渐______ (填“增强”或“减弱”,下同),单质的氧化性逐渐______ ,非金属性逐渐______ ,最简单氢化物的稳定性逐渐______ 。
(2)表中化学性质最稳定的元素为___________ (填元素符号)。
(3)⑥与③形成原子个数比为1:1的化合物,属于______ 化合物(填“离子”或“共价”)其电子式为:________ ,含有的化学键________ 。
(4)⑦与⑧的最高价氧化物对应的水化物是否可以相互反应______ (填“是”或“否”)。
(5)⑨的最高价氧化物对应的水化物为________ (填化学式)。
周期 | 族 | |||||||
Ⅰ A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | 0 | |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)按①→②→③→④的顺序,其原子半径逐渐
(2)表中化学性质最稳定的元素为
(3)⑥与③形成原子个数比为1:1的化合物,属于
(4)⑦与⑧的最高价氧化物对应的水化物是否可以相互反应
(5)⑨的最高价氧化物对应的水化物为
您最近一年使用:0次
名校
9 . 下列说法是否正确(正确的打“√”,不正确的打“×”)若不正确请说明理由。
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。_________ ;
(2)FeCl3与Cu的反应为置换反应。_________ ;
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。_________ ;
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。_________
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。
(2)FeCl3与Cu的反应为置换反应。
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。
您最近一年使用:0次
名校
解题方法
10 . 海洋是资源的宝库,蕴藏着丰富的氯、溴、碘等元素。氯、溴、碘是典型的非金属元素,都能与大多数金属化合生成盐,故统称为卤素;卤素单质都具有氧化性。
(1)氯在元素周期表中的位置___________
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式___________
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为: 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式___________ 。
(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: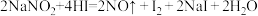
Ⅰ.上述反应的还原剂是___________
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有___________ (填字母)。
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是___________ 。(填字母)
A.NaCl B. C.
C. D.浓
D.浓
(1)氯在元素周期表中的位置
(2)氯气是重要的化工产品,工业可以由电解氯化钠溶液得到,同时还生成NaOH和H2.写出该电解过程的离子方程式
(3)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱顺序为:
 。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式
。试写出:在NaBr和KSCN的混合溶液中滴加少量(CN)2,请写出发生反应的离子方程式(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
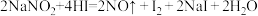
Ⅰ.上述反应的还原剂是
Ⅱ.根据上述反应,鉴别某白色固体是NaNO2还是NaCl。可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉溶液 ④白酒 ⑤食醋(稀的醋酸溶液),你认为必须选用的物质有
A.③⑤ B.①②⑤ C.①②④
Ⅲ.某厂废液中,含有2%~5%的NaNO2直接排放会造成污染,下列试剂能使NaNO2转化为N2防止污染的是
A.NaCl B.
 C.
C. D.浓
D.浓
您最近一年使用:0次



