解题方法
1 . 草酸 是一种白色粉末,
是一种白色粉末,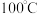 左右开始少量升华,熔点为
左右开始少量升华,熔点为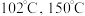 左右分解产生
左右分解产生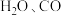 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为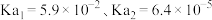 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中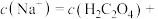
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,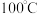 左右开始少量升华,熔点为
左右开始少量升华,熔点为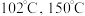 左右分解产生
左右分解产生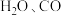 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为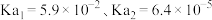 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为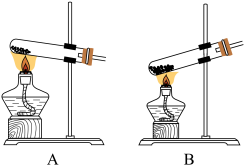
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
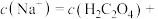
4.当
 时,计算该溶液的
时,计算该溶液的
您最近半年使用:0次
解题方法
2 . 过硫酸铵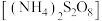 被广泛用于金属及半导体材料的表面处理剂和印刷线路的刻蚀剂。实验室选用下列装置制备
被广泛用于金属及半导体材料的表面处理剂和印刷线路的刻蚀剂。实验室选用下列装置制备 ,反应原理为
,反应原理为 。
。
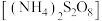 被广泛用于金属及半导体材料的表面处理剂和印刷线路的刻蚀剂。实验室选用下列装置制备
被广泛用于金属及半导体材料的表面处理剂和印刷线路的刻蚀剂。实验室选用下列装置制备 ,反应原理为
,反应原理为 。
。
A.装置 中固体药品为 中固体药品为 |
B.装置 的作用是干燥氨气 的作用是干燥氨气 |
C.制备 时仪器的连接顺序为 时仪器的连接顺序为 |
| D.装置D的作用是收集氨气 |
您最近半年使用:0次
解题方法
3 . 某同学欲利用如图装置制取能较长时间存在的 ,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
 ,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是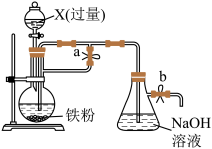
| A.X只能是稀硫酸 |
| B.实验开始时应先关闭止水夹a、打开止水夹b,再向烧瓶中加入X |
| C.反应一段时间后可在烧瓶中观察到白色沉淀 |
D.反应结束后若关闭b及分液漏斗活塞,则 可较长时间存在 可较长时间存在 |
您最近半年使用:0次
名校
解题方法
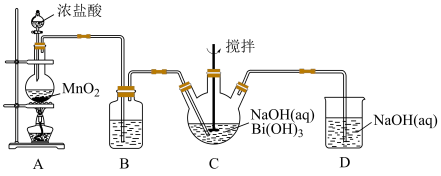
4 . 利用如图的装置制备NaBiO3(铋酸钠):
(1)A装置中反应的化学方程式:_______ 。
(2)B装置中试剂是_______ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是_______ 。
(4)D装置中反应的离子方程式:_______ 。
(5)实验完毕后,为了提高产品纯度,需要的操作有_______ 、过滤、洗涤、干燥。
(6)写出装置C中发生反应的化学方程式:_______ 。
(7)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是_______ 。
②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是_______ 。
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)D装置中反应的离子方程式:
(5)实验完毕后,为了提高产品纯度,需要的操作有
(6)写出装置C中发生反应的化学方程式:
(7)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是
您最近半年使用:0次
名校
5 . 三氯三(四氢呋喃)合铬(Ⅲ) 可催化烯烃加聚,制备的方法加下。
可催化烯烃加聚,制备的方法加下。
已知:① 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。
② 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水 :
:
某化学小组用 (沸点76.8℃)和
(沸点76.8℃)和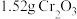 在高温下制备无水
在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
气体,实验装置如图所示: ,实验装置合理的连接顺序为A→G-→F→
,实验装置合理的连接顺序为A→G-→F→_______ →B(填装置字母标号,可重复使用)。
(2)装置乙名称为_______ ,装置D中粗导管的作用是_______ 。
(3)尾气处理时发生反应的离子方程式:_______ 。
Ⅱ.合成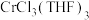 :
: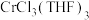 原理为:
原理为:
实验操作:按如图组装仪器,将步骤Ⅰ所得无水 和
和 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水四氢呋喃(THF),通
无水四氢呋喃(THF),通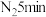 后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流
后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流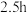 后再通入
后再通入 冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品
冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品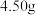 。
。_______ 。
(5)产品沿索氏提取器的管_______ (2或3)流回双颈烧瓶。
(6)已知Cr(Ⅱ)对该反应有催化作用,推断加入Zn粉发生反应的化学方程式为:_______ 。
(7)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是_______ 。
A.金属钠 B.浓硫酸 C.具有吸水能力的分子筛
(8)产品产率为____ %(结果保留小数点后一位)[已知: 的摩尔质量为
的摩尔质量为 ;
;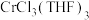 的摩尔质量为
的摩尔质量为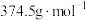 ]。
]。
 可催化烯烃加聚,制备的方法加下。
可催化烯烃加聚,制备的方法加下。已知:①
 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。②
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。Ⅰ.制备无水
 :
:某化学小组用
 (沸点76.8℃)和
(沸点76.8℃)和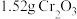 在高温下制备无水
在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
气体,实验装置如图所示: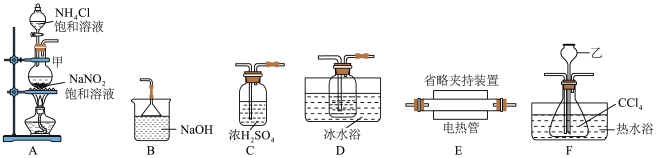
 ,实验装置合理的连接顺序为A→G-→F→
,实验装置合理的连接顺序为A→G-→F→(2)装置乙名称为
(3)尾气处理时发生反应的离子方程式:
Ⅱ.合成
 :
:①四氢呋喃(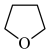 THF)为常见的有机溶剂,沸点66℃,易燃。
THF)为常见的有机溶剂,沸点66℃,易燃。
 原理为:
原理为:
实验操作:按如图组装仪器,将步骤Ⅰ所得无水
 和
和 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水四氢呋喃(THF),通
无水四氢呋喃(THF),通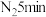 后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流
后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流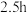 后再通入
后再通入 冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品
冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品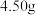 。
。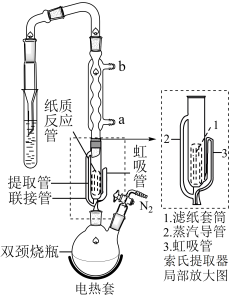
(5)产品沿索氏提取器的管
(6)已知Cr(Ⅱ)对该反应有催化作用,推断加入Zn粉发生反应的化学方程式为:
(7)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是
A.金属钠 B.浓硫酸 C.具有吸水能力的分子筛
(8)产品产率为
 的摩尔质量为
的摩尔质量为 ;
;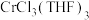 的摩尔质量为
的摩尔质量为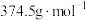 ]。
]。
您最近半年使用:0次
6 . 已知 H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2∙2H2O),为制取纯净的CuCl2∙2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
(1)本实验最适合的氧化剂X是___________(填序号)。
(2)物质Y可以选择以下___________。
(3)本实验用加碱沉淀法能不能达到目的?___________ (填“能”或“不能”)。
(4)加氧化剂的目的是___________ 。
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?___________ 。
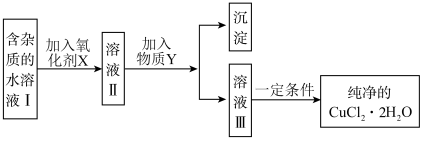
(1)本实验最适合的氧化剂X是___________(填序号)。
| A.K2Cr2O7 | B.NaClO | C. H2O2 | D.KMnO4 |
(2)物质Y可以选择以下___________。
| A.CuO | B.CuSO4 | C.Cu(OH)2 | D.KOH |
(3)本实验用加碱沉淀法能不能达到目的?
(4)加氧化剂的目的是
(5)最后蒸发结晶要想得到CuCl2∙2H2O晶体,应如何操作?
您最近半年使用:0次
7 . A、B、C、D是钠及其重要化合物,有着广泛的用途。已知B是常见的供氧剂,其相互转化关系如图所示(部分反应条件省略)。红热的铁能与水蒸气发生置换反应。回答下列问题:___________ 。
(2)B→C的化学方程式为___________ 。
(3)D→C的化学方程式为___________ 。
(4)若A为金属钠, 完全转化成D(涉及的其它反应物均足量),则生成D的质量为
完全转化成D(涉及的其它反应物均足量),则生成D的质量为___________ g。
(5)某同学探究铁与水蒸气的反应,进行了如下实验:___________ (填标号)。
A.先点燃湿棉花处的酒精灯,一段时间后再点燃还原铁粉处的酒精灯
B.先点燃还原铁粉处的酒精灯,一段时间后再点燃湿棉花处的酒精灯
C.同时点燃湿棉花处和还原铁粉处的酒精灯
②能否根据肥皂液冒气泡来证明铁与水蒸气发生了反应?___________ (填“能”或“不能”)。
③实验结束恢复到室温后,能否用磁铁将未参加反应的铁粉从反应后的固体中分离出来?___________ (填“能”或“不能”)。

(2)B→C的化学方程式为
(3)D→C的化学方程式为
(4)若A为金属钠,
 完全转化成D(涉及的其它反应物均足量),则生成D的质量为
完全转化成D(涉及的其它反应物均足量),则生成D的质量为(5)某同学探究铁与水蒸气的反应,进行了如下实验:
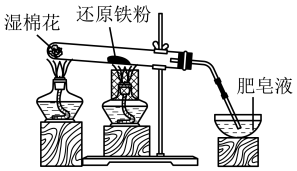
A.先点燃湿棉花处的酒精灯,一段时间后再点燃还原铁粉处的酒精灯
B.先点燃还原铁粉处的酒精灯,一段时间后再点燃湿棉花处的酒精灯
C.同时点燃湿棉花处和还原铁粉处的酒精灯
②能否根据肥皂液冒气泡来证明铁与水蒸气发生了反应?
③实验结束恢复到室温后,能否用磁铁将未参加反应的铁粉从反应后的固体中分离出来?
您最近半年使用:0次
8 . 二氯化二硫 可作硫化剂,实验室用如图装置(夹持装置已省略)通过硫与少量氯气在
可作硫化剂,实验室用如图装置(夹持装置已省略)通过硫与少量氯气在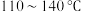 反应制得少量
反应制得少量 。下列说法正确的是
。下列说法正确的是 常温下是一种黄红色液体,沸点为
常温下是一种黄红色液体,沸点为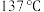 ,在空气中剧烈水解而“发烟”。
,在空气中剧烈水解而“发烟”。
 可作硫化剂,实验室用如图装置(夹持装置已省略)通过硫与少量氯气在
可作硫化剂,实验室用如图装置(夹持装置已省略)通过硫与少量氯气在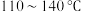 反应制得少量
反应制得少量 。下列说法正确的是
。下列说法正确的是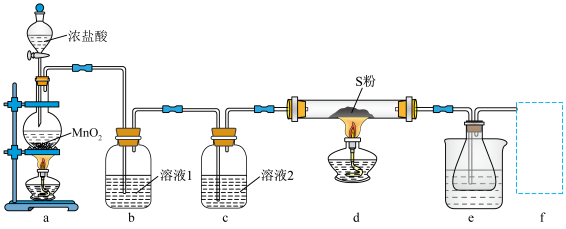
 常温下是一种黄红色液体,沸点为
常温下是一种黄红色液体,沸点为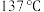 ,在空气中剧烈水解而“发烟”。
,在空气中剧烈水解而“发烟”。| A.溶液1,2分别为浓硫酸和饱和食盐水 |
| B.实验过程中,为了提高氯气的利用率,应先点燃d处的酒精灯,再点燃a处 |
C. 只含有极性共价键 只含有极性共价键 |
| D.f处的装置可以是装有碱石灰的球形干燥管 |
您最近半年使用:0次
名校
9 . 钒被称为“工业味精”,在发展现代工业、国防等方面发挥着重要的作用。 有强氧化性,在实验室以
有强氧化性,在实验室以 为原料制备氧钒(Ⅳ)碱式碳酸铵晶体,此晶体难溶于水,其化学式为
为原料制备氧钒(Ⅳ)碱式碳酸铵晶体,此晶体难溶于水,其化学式为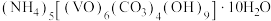 ,是制备热敏材料
,是制备热敏材料 的原料。过程如下:
的原料。过程如下:

已知:①氧化性: ;②
;② 能被
能被 氧化。
氧化。
1.步骤I中除生成 外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为
外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为___________ 。若只用浓盐酸与 反应也能制备
反应也能制备 溶液,从环保角度分析,使用
溶液,从环保角度分析,使用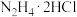 的目的是
的目的是___________ 。
步骤Ⅱ可在如图装置中进行: 被氧化,上述装置依次连接的合理顺序为c→
被氧化,上述装置依次连接的合理顺序为c→___________ (按气流方向,用小写字母表示)。盛有 溶液的仪器名称为
溶液的仪器名称为___________ 。
3.连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为___________ 。
4.实验结束时,将析出的产品过滤,用饱和 溶液洗涤。请从化学平衡的角度解释使用饱和
溶液洗涤。请从化学平衡的角度解释使用饱和 溶液洗涤晶体的原因:
溶液洗涤晶体的原因:___________ 。证明沉淀已经洗涤干净的方法是___________ 。
测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用稀硫酸溶解后得到的溶液,加入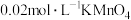 溶液至稍过量,加入某还原剂除去过量
溶液至稍过量,加入某还原剂除去过量 溶液,最后用
溶液,最后用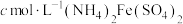 标准溶液滴定至终点(
标准溶液滴定至终点( ),消耗标准溶液的体积为b mL。
),消耗标准溶液的体积为b mL。
5.粗产品中钒的质量分数表达式为___________ (以 计,式量为67)。
计,式量为67)。
6.若 标准溶液部分变质,则测定结果
标准溶液部分变质,则测定结果___________ 。
A.偏高 B.偏低 C.无影响
 有强氧化性,在实验室以
有强氧化性,在实验室以 为原料制备氧钒(Ⅳ)碱式碳酸铵晶体,此晶体难溶于水,其化学式为
为原料制备氧钒(Ⅳ)碱式碳酸铵晶体,此晶体难溶于水,其化学式为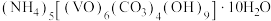 ,是制备热敏材料
,是制备热敏材料 的原料。过程如下:
的原料。过程如下:
已知:①氧化性:
 ;②
;② 能被
能被 氧化。
氧化。1.步骤I中除生成
 外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为
外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为 反应也能制备
反应也能制备 溶液,从环保角度分析,使用
溶液,从环保角度分析,使用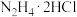 的目的是
的目的是步骤Ⅱ可在如图装置中进行:

 被氧化,上述装置依次连接的合理顺序为c→
被氧化,上述装置依次连接的合理顺序为c→ 溶液的仪器名称为
溶液的仪器名称为3.连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为
4.实验结束时,将析出的产品过滤,用饱和
 溶液洗涤。请从化学平衡的角度解释使用饱和
溶液洗涤。请从化学平衡的角度解释使用饱和 溶液洗涤晶体的原因:
溶液洗涤晶体的原因:测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用稀硫酸溶解后得到的溶液,加入
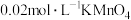 溶液至稍过量,加入某还原剂除去过量
溶液至稍过量,加入某还原剂除去过量 溶液,最后用
溶液,最后用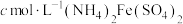 标准溶液滴定至终点(
标准溶液滴定至终点( ),消耗标准溶液的体积为b mL。
),消耗标准溶液的体积为b mL。5.粗产品中钒的质量分数表达式为
 计,式量为67)。
计,式量为67)。6.若
 标准溶液部分变质,则测定结果
标准溶液部分变质,则测定结果A.偏高 B.偏低 C.无影响
您最近半年使用:0次
名校
解题方法
10 . 亚硝酰氯(NOCl)可作为有机合成试剂。
已知:①
②沸点:NOCl为-6℃, 为-34℃,NO为-152℃。
为-34℃,NO为-152℃。
③NOCl易水解,能与 反应。
反应。
某研究小组用NO和 在如图所示装置中制备NOCl,并分离回收未反应的原料。
在如图所示装置中制备NOCl,并分离回收未反应的原料。
(1)通入 和NO前先通入氩气,作用是
和NO前先通入氩气,作用是___________ ;仪器D的名称是___________ 。
(2)将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是___________ 。
(3)实验所需的NO可用 和
和 溶液在稀
溶液在稀 中反应制得,离子反应方程式为
中反应制得,离子反应方程式为___________ 。
(4)为分离产物和未反应的原料,低温浴槽A的温度区间应控制在___________ ,仪器C收集的物质是___________ 。
(5)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应: ;
; 。若33.6mL(标况下)氮氧化物(只含NO和
。若33.6mL(标况下)氮氧化物(只含NO和 )与VmL 0.1mol/L NaOH溶液恰好完全反应,则
)与VmL 0.1mol/L NaOH溶液恰好完全反应,则
___________ 。
已知:①

②沸点:NOCl为-6℃,
 为-34℃,NO为-152℃。
为-34℃,NO为-152℃。③NOCl易水解,能与
 反应。
反应。某研究小组用NO和
 在如图所示装置中制备NOCl,并分离回收未反应的原料。
在如图所示装置中制备NOCl,并分离回收未反应的原料。
(1)通入
 和NO前先通入氩气,作用是
和NO前先通入氩气,作用是(2)将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是
(3)实验所需的NO可用
 和
和 溶液在稀
溶液在稀 中反应制得,离子反应方程式为
中反应制得,离子反应方程式为(4)为分离产物和未反应的原料,低温浴槽A的温度区间应控制在
(5)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
 ;
; 。若33.6mL(标况下)氮氧化物(只含NO和
。若33.6mL(标况下)氮氧化物(只含NO和 )与VmL 0.1mol/L NaOH溶液恰好完全反应,则
)与VmL 0.1mol/L NaOH溶液恰好完全反应,则
您最近半年使用:0次



