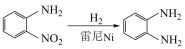
1 . 用如图装置(夹持装置已略去)进行 制备及性质实验,下列说法不正确的是
制备及性质实验,下列说法不正确的是
 制备及性质实验,下列说法不正确的是
制备及性质实验,下列说法不正确的是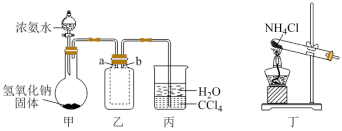
A.甲中制备 利用了 利用了 的分解反应,丁也可以用于制备氨气 的分解反应,丁也可以用于制备氨气 |
| B.乙中的集气瓶内a导管短、b导管长 |
C.不能将丙中的 换成食用油 换成食用油 |
D.向收集好的 中通入少量 中通入少量 ,可能观察到白烟 ,可能观察到白烟 |
您最近半年使用:0次
解题方法
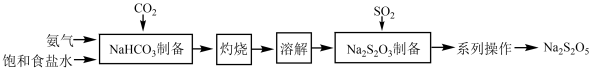
2 . 焦亚硫酸钠(Na2S2O5)在化学工业中用途广泛。其一种制备流程如下:
(1)SO2分子的VSEPR模型为___________ 。
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:___________ 。
②饱和碳酸氢钠溶液的作用是___________ 。
③三颈烧瓶中生成NaHCO3反应的化学方程式为___________ (NaHCO3为沉淀物)。
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是___________ 。
②写出步骤Ⅱ中反应的离子方程式:___________ 。
③写出I~Ⅳ步骤中总反应的化学方程式:___________ 。
(1)SO2分子的VSEPR模型为
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:
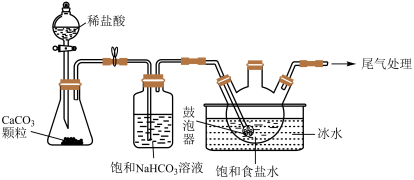
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成NaHCO3反应的化学方程式为
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出I~Ⅳ步骤中总反应的化学方程式:
您最近半年使用:0次
名校
解题方法
3 . 氧钒(Ⅳ)碱式碳酸铵为紫色晶体,难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
(1)V基态核外电子排布式为_______ 。N2H4·2HCl为离子化合物,1molN2H4·2HCl中含有的σ键数目为________ 。
(2)步骤1中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为______ 。
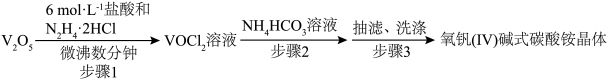
(3)步骤2可在如图装置(气密性良好)中进行。制备过程中,需向锥形瓶中通入CO2,作用是_________ ,所得紫色晶体残留的杂质离子主要为________ 。________ 。
(1)V基态核外电子排布式为
(2)步骤1中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为
(3)步骤2可在如图装置(气密性良好)中进行。制备过程中,需向锥形瓶中通入CO2,作用是

您最近半年使用:0次
解题方法
4 . 我国科研人员合成出了尺寸可调、品质高的CdE(E=S,Se,Te)量子点,并发展成为如今镉基量子点合成的通用方法。
(1)基态S原子的价电子排布式为___________ 。CdSe量子点直径尺寸在8~12nm,所以CdSe量子点常被称为___________ (填分散系名称)量子点。
(2)在一定条件下可由 和Se反应生成
和Se反应生成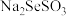 ,再由
,再由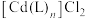 与
与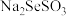 反应制得CdSe颗粒,制备流程和生成
反应制得CdSe颗粒,制备流程和生成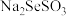 的实验装置如图所示:
的实验装置如图所示:___________ 。
② 与配位剂L形成配合物
与配位剂L形成配合物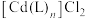 的化学方程式为
的化学方程式为___________ 。
③研究表明,CdSe的生成分两步,其中第二步是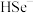 与
与 反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为
反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为___________ 。
④某化学小组通过实验探究了60℃下,其他条件相同时,反应时间、配位剂浓度分别对纳米颗粒平均粒径的影响,结果如图1、图2所示。___________ 。
(3)配位剂L是一种组成人体内蛋白质的氨基酸,其质谱图如图所示,分子中含硫质量分数为26.45%且巯基(-SH)与β-碳原子直接相连,则配位剂L的结构简式为___________ 。实验室中,还可以用___________ (填现代仪器分析法名称)获得其化学键或官能团的信息。
(1)基态S原子的价电子排布式为
(2)在一定条件下可由
 和Se反应生成
和Se反应生成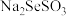 ,再由
,再由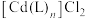 与
与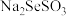 反应制得CdSe颗粒,制备流程和生成
反应制得CdSe颗粒,制备流程和生成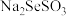 的实验装置如图所示:
的实验装置如图所示: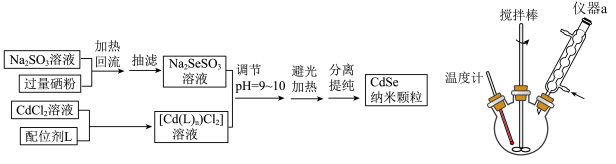
②
 与配位剂L形成配合物
与配位剂L形成配合物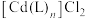 的化学方程式为
的化学方程式为③研究表明,CdSe的生成分两步,其中第二步是
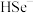 与
与 反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为
反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为④某化学小组通过实验探究了60℃下,其他条件相同时,反应时间、配位剂浓度分别对纳米颗粒平均粒径的影响,结果如图1、图2所示。

(3)配位剂L是一种组成人体内蛋白质的氨基酸,其质谱图如图所示,分子中含硫质量分数为26.45%且巯基(-SH)与β-碳原子直接相连,则配位剂L的结构简式为
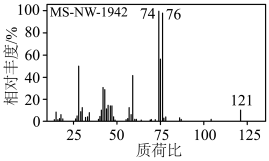
您最近半年使用:0次
名校
解题方法
5 . 金属 对
对 有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状
有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状 转化成多孔型雷尼
转化成多孔型雷尼 后,其催化活性显著提高。
后,其催化活性显著提高。
已知:①雷尼 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
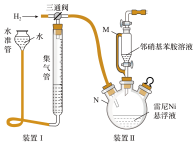
某实验小组制备雷尼 并探究其催化氢化性能的实验如下:
并探究其催化氢化性能的实验如下:
步骤1:雷尼 的制备
的制备
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存 和监测反应过程。
和监测反应过程。
1.操作(d)中,判断雷尼 被水洗净的方法是取最后一次洗涤液于试管中,滴加几滴
被水洗净的方法是取最后一次洗涤液于试管中,滴加几滴___________ ,如果溶液不变浅红色,则证明洗涤干净,否则没有洗涤干净。
2.操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是___________(单选)
3.邻硝基苯胺与盐酸反应的离子方程式是:___________
4.下列关于邻硝基苯胺描述正确的是(不定项)
5.向集气管中充入 时,三通阀的孔路位置如下图所示:发生氢化反应时,由集气管向装置Ⅱ供气,此时孔路位置需调节为
时,三通阀的孔路位置如下图所示:发生氢化反应时,由集气管向装置Ⅱ供气,此时孔路位置需调节为___________ 。 一段时间,目的是
一段时间,目的是___________ ;
7.装置Ⅰ可以判断氢化是否反应,反应完全的现象是___________ 。
 对
对 有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状
有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应,将块状 转化成多孔型雷尼
转化成多孔型雷尼 后,其催化活性显著提高。
后,其催化活性显著提高。已知:①雷尼
 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼
 并探究其催化氢化性能的实验如下:
并探究其催化氢化性能的实验如下:步骤1:雷尼
 的制备
的制备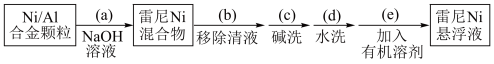
反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存
 和监测反应过程。
和监测反应过程。
|
|
| 反应原理 | 实验装置图 |
1.操作(d)中,判断雷尼
 被水洗净的方法是取最后一次洗涤液于试管中,滴加几滴
被水洗净的方法是取最后一次洗涤液于试管中,滴加几滴2.操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是___________(单选)
| A.丙酮 | B.四氯化碳 | C.乙醇 | D.正己烷 |
4.下列关于邻硝基苯胺描述正确的是(不定项)
| A.邻硝基苯胺属于芳香烃 |
| B.苯环上的一氯代物共有4种 |
| C.邻硝基苯胺具有两性 |
| D.邻硝基苯胺含有苯环和硝基的同分异构体还有3种(不包含邻硝基苯胺) |
 时,三通阀的孔路位置如下图所示:发生氢化反应时,由集气管向装置Ⅱ供气,此时孔路位置需调节为
时,三通阀的孔路位置如下图所示:发生氢化反应时,由集气管向装置Ⅱ供气,此时孔路位置需调节为向集气管中充入

集气管向装置Ⅱ供气 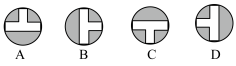
 一段时间,目的是
一段时间,目的是7.装置Ⅰ可以判断氢化是否反应,反应完全的现象是
您最近半年使用:0次
名校
解题方法
6 . 钽(Ta)和铌(Nb)的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
(2)浸渣的主要成分是_____ ,Ta2O5与氢氟酸反应的离子方程式为_____ 。
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为_____ 。
①流程中钠热还原法制备铌粉的化学方程式为_____ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为_____ 。
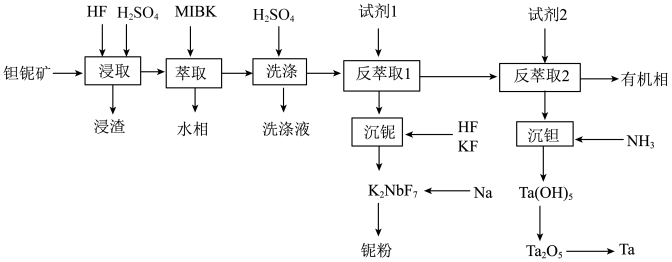
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
| A.陶瓷 | B.玻璃 | C.铅 | D.塑料 |
(2)浸渣的主要成分是
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为

①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为
您最近半年使用:0次
名校
解题方法
7 . 用镍铂合金废料(主要成分为 ,含少量
,含少量 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图: 的原子序数为78,推测其在元素周期表中的位置
的原子序数为78,推测其在元素周期表中的位置___________ 。
(2)含 滤渣(除
滤渣(除 外)的成分为
外)的成分为___________ 。
(3)用王水浸取“含 滤渣”可回收
滤渣”可回收 ,浸取时有
,浸取时有 和
和 生成,写出该反应的化学方程式
生成,写出该反应的化学方程式___________ 。
(4)在常温下,若酸浸后溶液中各离子浓度均为 且“滤渣1”为
且“滤渣1”为 ,则“除钴”步骤需要控制溶液的
,则“除钴”步骤需要控制溶液的 范围是
范围是___________ 。已知: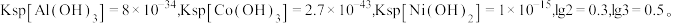
(5)加 调
调 的目的是
的目的是___________ 。
(6)“控温氧化”时控制其他条件一定, 的产率与温度和时间的关系如图。
的产率与温度和时间的关系如图。___________ 。
② 、
、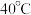 时反应后所得滤液主要为
时反应后所得滤液主要为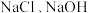 和
和 时反应后所得滤液主要为
时反应后所得滤液主要为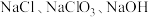 和
和 。反应相同时间,
。反应相同时间,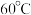 时
时 的产率低于
的产率低于 时,原因可能为
时,原因可能为___________ 。
(7) 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取
的纯度,进行如下实验:称取 样品,加入足量硫酸后,再加入
样品,加入足量硫酸后,再加入 标准溶液充分反应,加水定容至
标准溶液充分反应,加水定容至 取出
取出 ,用
,用 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液
标准溶液 。(
。( 被
被 还原为
还原为 ,不考虑
,不考虑 与
与 的反应),计算
的反应),计算 的质量分数
的质量分数___________ 。
 ,含少量
,含少量 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图: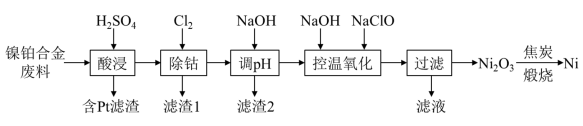
 的原子序数为78,推测其在元素周期表中的位置
的原子序数为78,推测其在元素周期表中的位置(2)含
 滤渣(除
滤渣(除 外)的成分为
外)的成分为(3)用王水浸取“含
 滤渣”可回收
滤渣”可回收 ,浸取时有
,浸取时有 和
和 生成,写出该反应的化学方程式
生成,写出该反应的化学方程式(4)在常温下,若酸浸后溶液中各离子浓度均为
 且“滤渣1”为
且“滤渣1”为 ,则“除钴”步骤需要控制溶液的
,则“除钴”步骤需要控制溶液的 范围是
范围是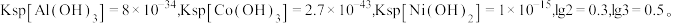
(5)加
 调
调 的目的是
的目的是(6)“控温氧化”时控制其他条件一定,
 的产率与温度和时间的关系如图。
的产率与温度和时间的关系如图。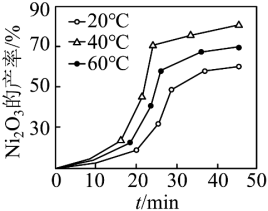
②
 、
、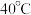 时反应后所得滤液主要为
时反应后所得滤液主要为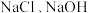 和
和 时反应后所得滤液主要为
时反应后所得滤液主要为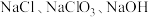 和
和 。反应相同时间,
。反应相同时间,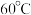 时
时 的产率低于
的产率低于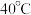 时,原因可能为
时,原因可能为(7)
 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取
的纯度,进行如下实验:称取 样品,加入足量硫酸后,再加入
样品,加入足量硫酸后,再加入 标准溶液充分反应,加水定容至
标准溶液充分反应,加水定容至 取出
取出 ,用
,用 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液
标准溶液 。(
。( 被
被 还原为
还原为 ,不考虑
,不考虑 与
与 的反应),计算
的反应),计算 的质量分数
的质量分数
您最近半年使用:0次
解题方法
8 . 硫酸四氨合铜晶体[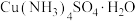 ]常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨。某学习小组在实验室中用废铜片制备硫酸四氨合铜晶体。回答相关问题:
]常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨。某学习小组在实验室中用废铜片制备硫酸四氨合铜晶体。回答相关问题:
Ⅰ.制备 溶液将废铜片在20%的
溶液将废铜片在20%的 溶液中加热煮沸,冷却后,取出铜片,用蒸馏水洗涤,然后将铜片置于适量稀硫酸中,边加热边在铜片表面通入
溶液中加热煮沸,冷却后,取出铜片,用蒸馏水洗涤,然后将铜片置于适量稀硫酸中,边加热边在铜片表面通入 ,直到铜片完全溶解。
,直到铜片完全溶解。
(1) 溶液的作用是
溶液的作用是___________ 。
(2)若将铜片先在空气中灼烧,使其氧化生成CuO,再溶解在稀硫酸中,产率会降低的原因是:___________ 。
Ⅱ.制备硫酸四氨合铜晶体
用如图所示装置制备硫酸四氨合铜晶体
(3)仪器B的名称是___________ ,溶液Y可以是___________ 。
(4)装置C中得到深蓝色溶液的总反应的化学方程式为___________ 。
(5)析出晶体时将深蓝色溶液加入乙醇中而不采用浓缩结晶的原因是___________ ,该实验中乙醇能降低物质溶解性的原因___________ 。
(6)洗涤时最适宜的洗涤剂是___________。
(7)为测定晶体中 的含量,将一足量的晶体溶于水,加入足量的沉淀剂再经过一系列操作后,得沉淀质量。该实验过程中需要用到以下哪些试剂
的含量,将一足量的晶体溶于水,加入足量的沉淀剂再经过一系列操作后,得沉淀质量。该实验过程中需要用到以下哪些试剂___________ 。
A.盐酸酸化的 溶液 B.
溶液 B. 溶液 C.硝酸酸化的
溶液 C.硝酸酸化的 溶液
溶液
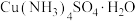 ]常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨。某学习小组在实验室中用废铜片制备硫酸四氨合铜晶体。回答相关问题:
]常用作杀虫剂、媒染剂。该物质为深蓝色固体,受热易失氨。某学习小组在实验室中用废铜片制备硫酸四氨合铜晶体。回答相关问题:Ⅰ.制备
 溶液将废铜片在20%的
溶液将废铜片在20%的 溶液中加热煮沸,冷却后,取出铜片,用蒸馏水洗涤,然后将铜片置于适量稀硫酸中,边加热边在铜片表面通入
溶液中加热煮沸,冷却后,取出铜片,用蒸馏水洗涤,然后将铜片置于适量稀硫酸中,边加热边在铜片表面通入 ,直到铜片完全溶解。
,直到铜片完全溶解。(1)
 溶液的作用是
溶液的作用是(2)若将铜片先在空气中灼烧,使其氧化生成CuO,再溶解在稀硫酸中,产率会降低的原因是:
Ⅱ.制备硫酸四氨合铜晶体
用如图所示装置制备硫酸四氨合铜晶体
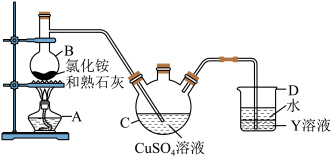
(3)仪器B的名称是
(4)装置C中得到深蓝色溶液的总反应的化学方程式为
(5)析出晶体时将深蓝色溶液加入乙醇中而不采用浓缩结晶的原因是
(6)洗涤时最适宜的洗涤剂是___________。
| A.乙醚 | B.乙醇 |
| C.乙醇与浓氨水体积比为1∶2的混合液 | D.浓氨水 |
(7)为测定晶体中
 的含量,将一足量的晶体溶于水,加入足量的沉淀剂再经过一系列操作后,得沉淀质量。该实验过程中需要用到以下哪些试剂
的含量,将一足量的晶体溶于水,加入足量的沉淀剂再经过一系列操作后,得沉淀质量。该实验过程中需要用到以下哪些试剂A.盐酸酸化的
 溶液 B.
溶液 B. 溶液 C.硝酸酸化的
溶液 C.硝酸酸化的 溶液
溶液
您最近半年使用:0次
名校
解题方法
9 .  和
和 锂离子电池的电极材料,可利用钛铁矿(主要成分为
锂离子电池的电极材料,可利用钛铁矿(主要成分为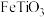 ,还含有少量
,还含有少量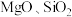 等杂质)来制备,工艺流程如图:
等杂质)来制备,工艺流程如图:
(1)化学上某些盐可写成氧化物的形式,如: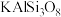 可写成
可写成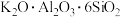 ,则
,则 可写成
可写成____________ 。
(2)“酸浸”后,钛主要以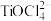 存在,写出相应反应的离子方程式:
存在,写出相应反应的离子方程式:____________ 。
(3)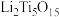 中Ti的化合价为
中Ti的化合价为 ,
,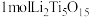 中含有过氧键的数目为
中含有过氧键的数目为____________ 。
(4) 与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是
与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是____________ 。
(5)向“滤液②”中加入双氧水和磷酸得到 ,写出离子方程式:
,写出离子方程式:____________ 。
(6)在“高温煅烧②”过程中,适当多加草酸的原因为____________ 。
(7)锂离子电池放电时, 由
由 结合
结合 得到,在
得到,在 中,若
中,若 ,材料中
,材料中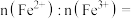
____________ .
 和
和 锂离子电池的电极材料,可利用钛铁矿(主要成分为
锂离子电池的电极材料,可利用钛铁矿(主要成分为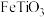 ,还含有少量
,还含有少量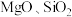 等杂质)来制备,工艺流程如图:
等杂质)来制备,工艺流程如图: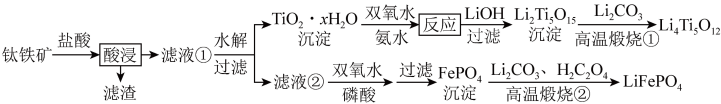
(1)化学上某些盐可写成氧化物的形式,如:
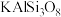 可写成
可写成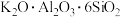 ,则
,则 可写成
可写成(2)“酸浸”后,钛主要以
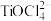 存在,写出相应反应的离子方程式:
存在,写出相应反应的离子方程式:(3)
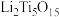 中Ti的化合价为
中Ti的化合价为 ,
,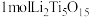 中含有过氧键的数目为
中含有过氧键的数目为(4)
 与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是
与双氧水、氨水反应40min,控制温度在40℃左右,温度不能高于40℃的原因是(5)向“滤液②”中加入双氧水和磷酸得到
 ,写出离子方程式:
,写出离子方程式:(6)在“高温煅烧②”过程中,适当多加草酸的原因为
(7)锂离子电池放电时,
 由
由 结合
结合 得到,在
得到,在 中,若
中,若 ,材料中
,材料中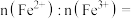
您最近半年使用:0次
解题方法
10 . 钛酸钡( )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: 如下表所示。
如下表所示。
注: 。
。
回答下列问题:
(1)浸渣的主要成分是_____ (填化学式)。
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。_____ 。图2中温度高于65℃,钛浸出率降低的原因可能是_____ 。
(3)“还原”时,主要反应的离子方程式为_____ ,检验“还原”后溶液中是否含 的试剂是
的试剂是_____ (填化学式)。
(4)“沉钛”中,先加入过量 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生_____ (填化学式)杂质,影响产率。“调 ”范围为
”范围为_____ 。
(5)“氧化焙烧”发生反应的化学方程式为_____ 。工业上,还可以直接将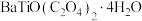 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是_____ 。
 )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: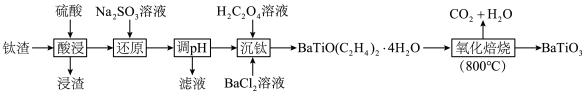
 如下表所示。
如下表所示。| 金属离子 |  |  |  |
开始沉淀/ | 1.5 | 6.3 | 0.5 |
完全沉淀/ | 2.8 | 8.3 | 2.5 |
 。
。回答下列问题:
(1)浸渣的主要成分是
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。
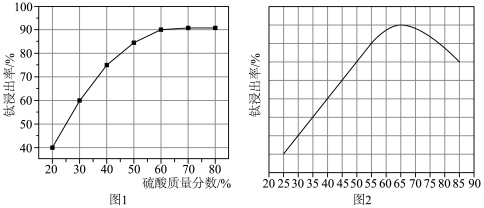
(3)“还原”时,主要反应的离子方程式为
 的试剂是
的试剂是(4)“沉钛”中,先加入过量
 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生 ”范围为
”范围为(5)“氧化焙烧”发生反应的化学方程式为
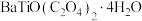 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是
您最近半年使用:0次