名校
1 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,以气体Z表示的平均反应速率为___________ 。1min时,正反应速率___________ (填“>”“<”或“=”)逆反应速率。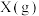 的平衡转化率为
的平衡转化率为___________ 。
(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
(4)反应开始至2min末,以气体X表示的平均反应速率为___________ ;反应开始时与反应达平衡状态时的压强之比为___________ 。
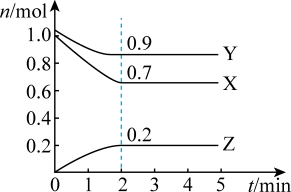
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
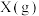 的平衡转化率为
的平衡转化率为(3)恒温恒容条件下,能说明该反应达到化学平衡状态的标志是___________。
①混合气体的压强不再变化
②混合气体的密度不再变化
③X的百分含量不再变化
④混合气体的平均相对分子质量不再变化
⑤v(X):v(Y)=3:1
| A.①②⑤ | B.①③④ | C.②③④ | D.③④⑤ |
(4)反应开始至2min末,以气体X表示的平均反应速率为
您最近半年使用:0次
名校
2 . 回答下列问题
(1)向某体积固定的密闭容器中加入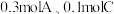 和
和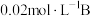 三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
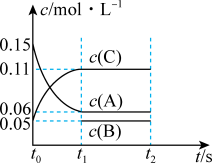
①该密闭容器的体积为_______ 升;若 ,则
,则 内用
内用 表示反应速率
表示反应速率
_______ ;
②写出该反应的化学方程式:_______ 。
③能使该反应的速率增大的是_______ 。
A.及时分离出C气体 B.适当升高温度
C.充入He气增大压强 D.选择高效催化剂
④下列物质表示该反应的化学反应速率最快的是_______ 。
A.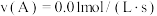
B.
C.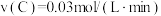
(2)已知断裂几种化学键要吸收的能量如下:
已知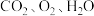 的结构式分别为
的结构式分别为 ,
, ,
, 。
。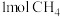 在
在 中完全燃烧生成气态
中完全燃烧生成气态 和气态水时放出
和气态水时放出_______  热量。
热量。
(3)燃料电池是一种高效、环境友好的供电装置,如图为氢气燃料电池的工作原理示意图, 均为惰性电极。
均为惰性电极。

①使用时,氢气从_______ 口通入(填“ ”或“B”)
”或“B”)
② 极的电极反应为:
极的电极反应为:_______ 。
(1)向某体积固定的密闭容器中加入
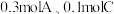 和
和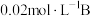 三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。请回答:
①该密闭容器的体积为
 ,则
,则 内用
内用 表示反应速率
表示反应速率
②写出该反应的化学方程式:
③能使该反应的速率增大的是
A.及时分离出C气体 B.适当升高温度
C.充入He气增大压强 D.选择高效催化剂
④下列物质表示该反应的化学反应速率最快的是
A.
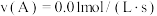
B.

C.
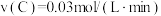
(2)已知断裂几种化学键要吸收的能量如下:
| 化学键 |
|
|
|
|
断裂 键吸收的能量 键吸收的能量 | 415 | 497 | 745 | 463 |
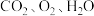 的结构式分别为
的结构式分别为 ,
, ,
, 。
。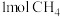 在
在 中完全燃烧生成气态
中完全燃烧生成气态 和气态水时放出
和气态水时放出 热量。
热量。(3)燃料电池是一种高效、环境友好的供电装置,如图为氢气燃料电池的工作原理示意图,
 均为惰性电极。
均为惰性电极。
①使用时,氢气从
 ”或“B”)
”或“B”)②
 极的电极反应为:
极的电极反应为:
您最近半年使用:0次
解题方法
3 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为 和
和 ),其反应的化学方程式为
),其反应的化学方程式为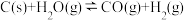 ,请回答下列问题:
,请回答下列问题:
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是___________。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是___________ 。
A.充入He使容器压强增大,能提高反应速率
B.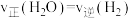 ,说明反应达到平衡状态
,说明反应达到平衡状态
C.容器中焦炭的质量不再变化,说明反应达到平衡状态
D.混合气体的密度不再发生改变时,反应达平衡状态
E.升高温度,能使正反应速率增大,逆反应速率减小
(3)298K时,1gH2燃烧生成H2O(g)放热121kJ,1molH2O(l)蒸发吸热44kJ,表示H2燃烧热的热化学方程式为___________ 。
(4)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应N2+3H2⇌2NH3,若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为___________ ,N2的转化率为___________ ,欲提高合成氨的反应速率可采取的措施为___________ 。(任意答2点)
(5)工业制备硝酸过程中,通常对氨气进行催化氧化,其化学方程式为___________ 。
 和
和 ),其反应的化学方程式为
),其反应的化学方程式为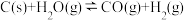 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是___________。

| A.铝粉与氧化铁的反应 |
B.氯化铵与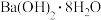 的反应 的反应 |
C.锌片与稀硫酸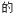 反应 反应 |
| D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是
A.充入He使容器压强增大,能提高反应速率
B.
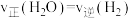 ,说明反应达到平衡状态
,说明反应达到平衡状态C.容器中焦炭的质量不再变化,说明反应达到平衡状态
D.混合气体的密度不再发生改变时,反应达平衡状态
E.升高温度,能使正反应速率增大,逆反应速率减小
(3)298K时,1gH2燃烧生成H2O(g)放热121kJ,1molH2O(l)蒸发吸热44kJ,表示H2燃烧热的热化学方程式为
(4)恒温下,将1molN2和3molH2置于体积为2L的密闭容器中进行反应N2+3H2⇌2NH3,若5min时测得氢气浓度为0.9mol/L,则用氨气表示5min内的化学反应速率为
(5)工业制备硝酸过程中,通常对氨气进行催化氧化,其化学方程式为
您最近半年使用:0次
4 . 碳单质及其化合物广泛存在于人们的生产和生活中。研究碳单质及其化合物的结构、性质、转化是科技工作者的研究热点。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X: 的最外层电子排布式是
的最外层电子排布式是________________ 。
②X中除含共价键外,还含配位键, X含
X含________ mol配位键。
(2)温度为T时,在恒容密闭容器中充入一定量的 和
和 混合气体,发生反应:
混合气体,发生反应:

 。
。
已知该反应存在: ,
,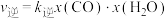 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的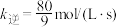 ,则
,则
________ 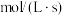 ,压强平衡常数
,压强平衡常数
________ 。
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(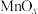 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。 、
、 反应的化学方程式是
反应的化学方程式是________________________ 。
②下列有关说法中,正确的有________ 。
A.相比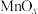 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率
B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气( 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:
反应ⅰ.
反应ⅱ.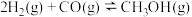
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(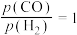 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含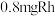 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为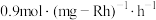 ,反应速率
,反应速率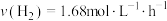 。
。
【注】(催化剂)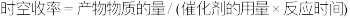 。
。
①反应速率
________  。
。
②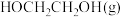 的时空收率为
的时空收率为________ 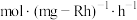 。
。
(1)实验室常用邻二氮菲检验亚铁离子,生成橙红色的邻二氮菲亚铁络离子X:

 的最外层电子排布式是
的最外层电子排布式是②X中除含共价键外,还含配位键,
 X含
X含(2)温度为T时,在恒容密闭容器中充入一定量的
 和
和 混合气体,发生反应:
混合气体,发生反应:
 。
。已知该反应存在:
 ,
,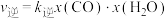 ,其中
,其中 、
、 为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若
为速率常数,x为相关物质的物质的量分数。反应达到平衡时,若 、
、 转化率均为60%,且该反应的
转化率均为60%,且该反应的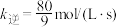 ,则
,则
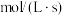 ,压强平衡常数
,压强平衡常数
(3)氧化锰八面体分子筛(简称OMS-2)是一种纳米级别的新型环保催化剂,对挥发性有机物(VOCs)的氧化去除有着很好的催化作用。如用OMS-2为催化剂(
 为对比催化实验)氧化处理甲醛的反应生成
为对比催化实验)氧化处理甲醛的反应生成 、
、 ,在等时间内HCHO转化率随温度的变化关系如图所示。
,在等时间内HCHO转化率随温度的变化关系如图所示。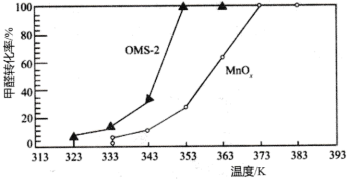
 、
、 反应的化学方程式是
反应的化学方程式是②下列有关说法中,正确的有
A.相比
 ,OMS-2能提高甲醛氧化的平衡转化率
,OMS-2能提高甲醛氧化的平衡转化率B.OMS-2能降低甲醛氧化反应的活化能
C.OMS-2作为纳米材料,表面积大,催化效果好
D.两种催化剂的平衡转化率均随温度的升高而增大
(4)以合成气(
 、
、 )为原料合成乙二醇的反应:
)为原料合成乙二醇的反应:反应ⅰ.

反应ⅱ.
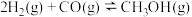
温度为473K,在恒容(2.0L)密闭容器中充入一定量的合成气(
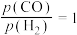 ,测得体系总压为40MPa),在
,测得体系总压为40MPa),在 (其中含
(其中含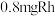 )催化剂作用下,进行上述反应。测得
)催化剂作用下,进行上述反应。测得 的时空收率为
的时空收率为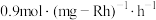 ,反应速率
,反应速率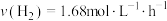 。
。【注】(催化剂)
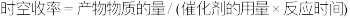 。
。①反应速率

 。
。②
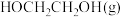 的时空收率为
的时空收率为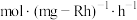 。
。
您最近半年使用:0次
5 . 某温度下,在1 L恒容密闭容器中3.0 mol A发生反应 ,有关数据如下:
,有关数据如下:
下列说法错误的是
 ,有关数据如下:
,有关数据如下:| 时间段/min | 产物C的平均生成速率/mol·L-1·min-1 |
| 0~2 | 0.20 |
| 0~4 | 0.15 |
| 0~6 | 0.10 |
| A.当容器内压强不再变化时,反应达到平衡状态 |
| B.2 min时,加入0.2 mol C,此时平衡逆向移动 |
| C.该温度下的平衡常数K=0.108 |
| D.5 min时,A的物质的量为2.1 mol |
您最近半年使用:0次
6 . 利用天然气制乙炔,反应原理如下:
①

②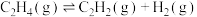

在1L恒容密闭反应器中充入适量的 ,发生上述反应,测得某温度时各含碳物质的物质的量随时间变化如图所示。下列叙述正确的是
,发生上述反应,测得某温度时各含碳物质的物质的量随时间变化如图所示。下列叙述正确的是
①


②
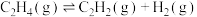

在1L恒容密闭反应器中充入适量的
 ,发生上述反应,测得某温度时各含碳物质的物质的量随时间变化如图所示。下列叙述正确的是
,发生上述反应,测得某温度时各含碳物质的物质的量随时间变化如图所示。下列叙述正确的是
| A.M点正反应速率小于逆反应速率 | B.反应前30min以乙烯生成为主 |
| C.若60min后升温,乙曲线上移,甲曲线下移 | D.0~40min内 平均速率为2. 平均速率为2.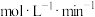 |
您最近半年使用:0次
7 . 化学反应原理与生产、生活密切相关。
(1)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是___________(填字母)。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图1。___________ 。
②该反应达到平衡状态的标志是___________ (填字母)。
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)可以用图示法分析化学反应中的能量变化。观察图2,该反应2HI(g) I2(g)+H2(g)能量
I2(g)+H2(g)能量___________ (增加、减小)___________ kJ/mol。
(1)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是___________(填字母)。
| A.蒸馏水 | B.KNO3溶液 | C.CH3COONa固体 | D.CuSO4溶液 |
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图1。
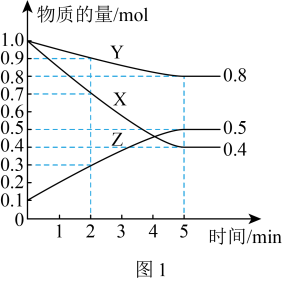
②该反应达到平衡状态的标志是
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率
(3)可以用图示法分析化学反应中的能量变化。观察图2,该反应2HI(g)
 I2(g)+H2(g)能量
I2(g)+H2(g)能量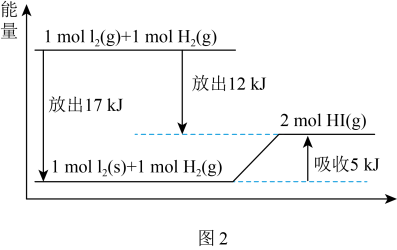
您最近半年使用:0次
8 . 完成下列问题。
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。___________ ,当电路中有0.2mol电子通过时,负极的质量减少___________ g。
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置负极材料为___________ 。
(2)当在a附近有气泡产生,b电极逐渐溶解,则___________ (a或b)作负极。
(3) (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
①该反应为吸热反应,则断裂反应物的化学键要吸收的能量___________ (填“大于”、“小于”或“等于”)形成生成物的化学键要放出的能量。
②下列可以说明该反应达到平衡的是___________ 。
A.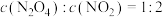 B.
B.
C.容器内气体的颜色不再变化 D.混合气体的压强不再变化
③在温度为T的条件下,向该恒容密闭容器中充入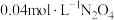 ,
, 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。 的反应速率为
的反应速率为___________ ,反应进行到16min时, 的转化率是
的转化率是___________ 。
(1)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
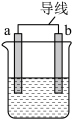
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置负极材料为
(2)当在a附近有气泡产生,b电极逐渐溶解,则
(3)
 (红棕色)和
(红棕色)和 (无色)之间发生反应:
(无色)之间发生反应: 。将一定量
。将一定量 气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
气体充入体积为2L的恒容密闭容器中,控制反应温度为T。①该反应为吸热反应,则断裂反应物的化学键要吸收的能量
②下列可以说明该反应达到平衡的是
A.
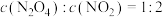 B.
B.
C.容器内气体的颜色不再变化 D.混合气体的压强不再变化
③在温度为T的条件下,向该恒容密闭容器中充入
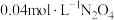 ,
, 随时间的变化曲线如图所示。
随时间的变化曲线如图所示。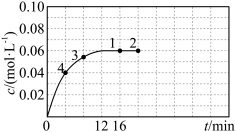
 的反应速率为
的反应速率为 的转化率是
的转化率是
您最近半年使用:0次
9 . 2022年12月4日神舟十四号载人飞船成功返回地面,圆满完成飞行任务。载人航天工程对科学研究及太空资源开发具有重要意义。
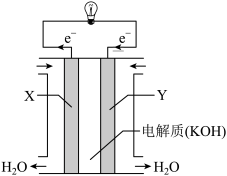
(1)氢氧燃料电池(如图所示)反应生成的水可作为航天员的饮用水,由图示的电子转移方向判断Y气体是___________ ,OH-向___________ (填“正”或“负”)极作定向移动,负极的电极反应式为___________ 。
①镉镍蓄电池的工作原理为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2.当飞船运行到地影区时,镉镍蓄电池为飞船供电,此时在正极反应的物质是
Cd(OH)2+2Ni(OH)2.当飞船运行到地影区时,镉镍蓄电池为飞船供电,此时在正极反应的物质是___________ ,负极附近溶液的碱性___________ (填“增强”“减弱”或“不变”)。
②应急电池在紧急状况下会自动启动,工作原理为Zn+A2O+H2O 2Ag+Zn(OH)2,工作时,当消耗32.5gZn时,理论上外电路转移的电子数目为
2Ag+Zn(OH)2,工作时,当消耗32.5gZn时,理论上外电路转移的电子数目为___________ 。
(3)在体积为2L的绝热刚性密闭容器中发生反应: ,
,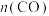 随时间的变化如下表所示:
随时间的变化如下表所示:
①用 表示0~2s内该反应的平均速率v=
表示0~2s内该反应的平均速率v=___________ mol/(L•s)。
②从表格数据可知,该反应速率先加快,再减慢,请说明反应速率加快的原因是___________ 。
③对于该反应,下列说法正确的是___________ 。
A.当混合气体平均摩尔质量不变,说明反应达到平衡
B.当消耗1molCO,同时生成1mol ,说明反应达到平衡
,说明反应达到平衡
C.当温度不变,说明反应达到平衡
D.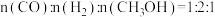 ,说明反应已达平衡
,说明反应已达平衡
(1)氢氧燃料电池(如图所示)反应生成的水可作为航天员的饮用水,由图示的电子转移方向判断Y气体是
①镉镍蓄电池的工作原理为:Cd+2NiOOH+2H2O
 Cd(OH)2+2Ni(OH)2.当飞船运行到地影区时,镉镍蓄电池为飞船供电,此时在正极反应的物质是
Cd(OH)2+2Ni(OH)2.当飞船运行到地影区时,镉镍蓄电池为飞船供电,此时在正极反应的物质是②应急电池在紧急状况下会自动启动,工作原理为Zn+A2O+H2O
 2Ag+Zn(OH)2,工作时,当消耗32.5gZn时,理论上外电路转移的电子数目为
2Ag+Zn(OH)2,工作时,当消耗32.5gZn时,理论上外电路转移的电子数目为(3)在体积为2L的绝热刚性密闭容器中发生反应:
 ,
,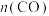 随时间的变化如下表所示:
随时间的变化如下表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
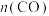 /mol /mol | 0.40 | 0.32 | 0.20 | 0.10 | 0.06 | 0.06 | 0.06 |
 表示0~2s内该反应的平均速率v=
表示0~2s内该反应的平均速率v=②从表格数据可知,该反应速率先加快,再减慢,请说明反应速率加快的原因是
③对于该反应,下列说法正确的是
A.当混合气体平均摩尔质量不变,说明反应达到平衡
B.当消耗1molCO,同时生成1mol
 ,说明反应达到平衡
,说明反应达到平衡C.当温度不变,说明反应达到平衡
D.
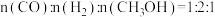 ,说明反应已达平衡
,说明反应已达平衡
您最近半年使用:0次
解题方法
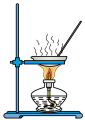
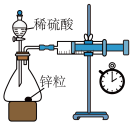
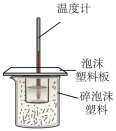
10 . 定量实验是学习化学的重要途径。下列所示装置或操作能达到实验目的的是
| ① | ② | ③ | ④ |
|
|
|
|
| A.图①:测定硫酸铜晶体中结晶水的含量 | B.图②:配制 NaOH溶液 NaOH溶液 |
| C.图③:测量锌与稀硫酸反应的反应速率 | D.图④:中和热的测定 |
您最近半年使用:0次